Нативна структура білка визначається. Білки, їх будова та біологічна роль
Нативні та ненативні білки
Нативні білки - це ті, які містять усі незамінні амінокислоти, необхідні організму для будівництва та відновлення м'язів та органів.
Ненативні білки - це ті, які містять лише деякі з амінокислот, але тим не менш мають значну харчову цінність.
Нативні білки є в м'ясі, рибі, морепродуктах, птиці, яйцях та сирі. Вони багаті також на вітаміни групи В.
Ненативні білки містяться в зернових, бобових, горіхах, насінні та деяких листових овочах. А також в горіховому маслі, такому як арахісове, мигдальне та кешью.
Ненативні білки корисно їсти у поєднанні з іншими продуктами. Вживаючи в їжу поєднання певних ненативних білків, можна отримати за один прийом усі незамінні амінокислоти.
З книги Ортотрофія: основи правильного харчування та лікувального голодування автора Герберт Макголфін Шелтон З книги Код Жінки автора Аліса Вітті З книги Харчування та дієта для спортсменів автора Олена Анатоліївна Бойко З книги Стретчинг для здоров'я та довголіття автора Ванесса Томпсон З книги Реальні рецепти проти целюліту.5 хв на день автора Христина Олександрівна Кулагіна З книги Діабет. Попередження, діагностика та лікування традиційними та нетрадиційними методами автора Віолетта Романівна Хамідова З книги Голлівудська дієта автора Д. Б. Абрамов З книги Як не перетворитися на Бабу Ягу автора Доктор Нонна З книги Кишеньковий лічильник калорій автора Юлія Лужковська З книги Здорові звички. Дієта доктора Іонової автора Лідія ІоноваЛекція 2а
2.1. Фізичні та хімічні властивості білків.
Білки, як і інші органічні сполуки, мають низку фізико-хімічних властивостей, які зумовлені структурою їх молекул.
Хімічнівластивості білків відрізняються винятковим розмаїттям. Маючи амінокислотні радикали різної хімічної природи, білкові молекули здатні вступати в різноманітні реакції.
2.1.1. Кислотно-осн оні властивості білкових молекул
Подібно до амінокислот, білкипоєднують у собі, як осн овні, так і кислотнівластивості, тобто є амфотерними поліелектролітами.
У білках основний внесоку формування кислотно-основних властивостей вносять заряджені радикалирозташовані на поверхні білкової глобули.
Основ овнівластивості білків пов'язані з такими амінокислотами, як аргінін, лізині гістидин(тобто мають додатковіаміно-або іміногрупи).
Кислотнівластивості білків пов'язані з присутністю глутаміновийі аспарагіновоїамінокислот (мають додаткову карбоксильну групу).
Розчинність білків.
Кожен білок має певну розчинність, яка залежить від природи самого білка і складу розчинника.
Розчинність білка залежить від:
а) амінокислотного складу, тобто від заряду білкової молекули: що більше білок містить полярних і заряджених амінокислотних радикалів, то вище його розчинність.
б) наявності гідратного шару (полярні та заряджені радикали амінокислот пов'язують диполі води, які й утворюють навколо молекули білка гідратний шар).
Додавання до водного розчину білка водовіднімних речовин (спирт, ацетон) викликає руйнування гідратного шару і випадає білок в осад.
Денатурація білків
Специфічні біологічні функціїбілків, наприклад ферментів чи гормонів, залежить від них конформації,порушення якої можуть призвести до втрати біологічної активності. У зв'язку з цим, про білку, який має нормальну конформацію, кажуть, що він знаходиться в нативному (природному) стані.
Нативний білок це білок, який має конформацію (просторову структуру), що обумовлює специфічну біологічну функціюмолекули.
Досить м'які зміни фізичних умов, у тому числі зміни pH, температури або обробка водними розчинами деяких органічних речовин (детергентів, етанолу або сечовини) можуть порушити цю конформацію. У білках, підданих таким впливам, відбувається денатурація (Мал. 2.1):
Мал. 2.1. Денатурація білкової молекули
Денатурація білків- це руйнування четвертинної, третинної та частково вторинної структур шляхом розриву слабких нековалентних взаємодій (водневих, іонних, гідрофобних) та дисульфідних зв'язків, що супроводжуються втратою функції білка.
Слід розрізняти денатурацію та деградацію білків. При деградаціївідбувається фрагментація первинної структури та утворення фрагментів білкової макромолекули, т. е. утворюються біологічно неактивні олігопептиди .
Прикладом денатурації білкової молекули може бути теплова денатурація білківу розчинах при 50-60º, обумовлена розривом нековалентних взаємодій, з допомогою яких утворюється третинна структура.
Денатурація, що здійснюється в м'яких умов, часто виявляється оборотний, тобто при видаленні денатуруючого агента відбувається відновлення ( ренатурація) нативної конформації білкової молекули. Для ряду білків відновлення може бути 100%, причому це стосується не тільки водневих і гідрофобних зв'язків, але і дисульфідних містків.
При оборотної денатураціївідновлюється та біологічна активність білків.
Ці дані є додатковим доказом того, що вторинна і третинна структури білків зумовлені амінокислотною послідовністю.
МОДУЛЬ 1 БУДОВА, ВЛАСТИВОСТІ ТА ФУНКЦІЇ БІЛКІВ
МОДУЛЬ 1 БУДОВА, ВЛАСТИВОСТІ ТА ФУНКЦІЇ БІЛКІВ
Структура модуля | Теми |
Модульна одиниця 1 | 1.1. Структурна організація білків. Етапи формування нативної конформації білків 1.2. Основи функціонування білків. Ліки як ліганди, що впливають на функцію білків 1.3. Денатурація білків та можливість їх спонтанної ренативації |
Модульна одиниця 2 | 1.4. Особливості будови та функціонування олігомерних білків на прикладі гемоглобіну 1.5. Підтримка нативної конформації білків за умов клітини 1.6. Різноманітність білків. Сімейства білків на прикладі імуноглобулінів 1.7. Фізико-хімічні властивості білків та методи їх поділу |
Модульна одиниця 1 СТРУКТУРНА ОРГАНІЗАЦІЯ МОНОМІРНИХ БІЛКІВ І ОСНОВИ ЇХ ФУНКЦІОНУВАННЯ
Цілі вивчення Вміти:
1. Використовувати знання про особливості структури білків та залежності функцій білків від їх структури для розуміння механізмів розвитку спадкових та набутих протеїнопатій.
2. Пояснювати механізми лікувальної діїдеяких ліків як лігандів, що взаємодіють з білками та змінюють їх активність.
3. Використовувати знання про будову та конформаційну лабільність білків для розуміння їх структурно-функціональної нестійкості та схильності до денатурації в умовах, що змінюються.
4. Пояснювати застосування денатуруючих агентів як засобів для стерилізації медичного матеріалу та інструментів, а також як антисептиків.
Знати:
1. Рівні структурної організації білків.
2. Значення первинної структури білків, що визначає їх структурне та функціональне різноманіття.
3. Механізм формування у білках активного центру та його специфічна взаємодія з лігандом, що лежить в основі функціонування білків.
4. Приклади впливу екзогенних лігандів (ліків, токсинів, отрут) на конформацію та функціональну активність білків.
5. Причини та наслідки денатурації білків, фактори, що викликають денатурацію.
6. Приклади використання денатуруючих факторів у медицині як антисептиків та засобів для стерилізації медичних інструментів.
ТЕМА 1.1. СТРУКТУРНА ОРГАНІЗАЦІЯ БІЛКІВ. ЕТАПИ ФОРМУВАННЯ НАТИВНОЇ
КОНФОРМАЦІЇ БІЛКІВ
Білки - це полімерні молекули, мономерами яких є лише 20 -амінокислот. Набір та порядок з'єднання амінокислот у білку визначається будовою генів у ДНК індивідів. Кожен білок відповідно до його специфічної структури виконує властиву йому функцію. Набір білків даного організмувизначає його фенотипічні особливості, а також наявність спадкових хвороб або схильність до їхнього розвитку.
1. Амінокислоти, що входять до складу білків. Пептидна зв'язок.Білки - полімери, побудовані з мономерів - 20 -амінокислот, загальна формула яких
Амінокислоти розрізняються за будовою, розмірами, фізико-хімічними властивостями радикалів, приєднаних до α-вуглецевого атома. Функціональні групи амінокислот визначають особливості властивостей різних -амінокислот. Радикали, що зустрічаються в α-амінокислотах, можна розділити на кілька груп:
Пролін,на відміну від інших 19 мономерів білків, не амінокислота, а імінокислота, радикал у пролині пов'язаний як з α-вуглецевим атомом, так і з іміногрупою
 Амінокислоти розрізняються по розчинності у воді.Це з здатністю радикалів взаємодіяти з водою (гідратуватися).
Амінокислоти розрізняються по розчинності у воді.Це з здатністю радикалів взаємодіяти з водою (гідратуватися).
До гідрофільнимвідносяться радикали, що містять аніонні, катіонні та полярні незаряджені функціональні групи.
До гідрофобнимвідносяться радикали, що містять метильні групи, аліфатичні ланцюги або цикли.
2. Пептидні зв'язки з'єднують амінокислоти в пептиди.При синтезі пептиду α-карбоксильна група однієї амінокислоти взаємодіє з α-аміногрупою іншої амінокислоти з утворенням пептидного зв'язку:
Білки є поліпептиди, тобто. лінійні полімери α-амінокислот, з'єднаних пептидним зв'язком (рис. 1.1.)
 Мал. 1.1. Терміни, що використовуються при описі будови пептидів
Мал. 1.1. Терміни, що використовуються при описі будови пептидів
Мономери амінокислот, що входять до складу поліпептидів, називаються амінокислотними залишками.Ланцюг повторюваних груп - NH-CH-CO- утворює пептидний кістяк.Амінокислотний залишок, що має вільну -аміногрупу, називається N-кінцевим, а має вільну -карбоксильну групу - С-кінцевим. Пептиди записують і читають з N-кінця до С-кінця.
Пептидна зв'язок, утворена іміногрупою проліну, відрізняється від інших пептидних зв'язків: у атома азоту пептидної групи відсутній водень,
замість нього є зв'язок з радикалом, в результаті одна сторона циклу включається в пептидний кістяк:
 Пептиди відрізняються амінокислотним складом, кількістю амінокислот і порядком з'єднання амінокислот, наприклад, Сер-Ала-Глу-Гіс та Гіс-Глу-Ала-Сер - два різні пептиди.
Пептиди відрізняються амінокислотним складом, кількістю амінокислот і порядком з'єднання амінокислот, наприклад, Сер-Ала-Глу-Гіс та Гіс-Глу-Ала-Сер - два різні пептиди.
Пептидні зв'язки дуже міцні, і для їх хімічного неферментативного гідролізу потрібні жорсткі умови: білок, що аналізується, гідролізують у концентрованій соляній кислоті при температурі близько 110° протягом 24 годин. У живій клітині пептидні зв'язки можуть розриватися за допомогою протеолітичних ферментів,званих протеазамиабо пептидгідролазами.
3. Первинна структура білків.Амінокислотні залишки в пептидних ланцюгах різних білків чергуються не випадково, а розташовані в певному порядку. Лінійна послідовність або порядок чергування амінокислотних залишків у поліпептидному ланцюгу називається первинною структурою білка.
Первинна структура кожного індивідуального білка закодована в молекулі ДНК (в ділянці, що називається геном) та реалізується в ході транскрипції (переписування інформації на мРНК) та трансляції (синтез первинної структури білка). Отже, первинна структура білків індивідуальної людини - спадкова інформація, що передається від батьків дітям, що визначає особливості будови білків даного організму, від яких залежить функція наявних білків (рис. 1.2.).
 Мал. 1.2. Взаємозв'язок між генотипом та конформацією білків, що синтезуються в організмі індивіда
Мал. 1.2. Взаємозв'язок між генотипом та конформацією білків, що синтезуються в організмі індивіда
Кожен із приблизно 100 000 індивідуальних білків в організмі людини має унікальнупервинну структуру. У молекулах одного типу білка (наприклад, альбумін) однакове чергування амінокислотних залишків, що відрізняє альбумін від будь-якого іншого індивідуального білка.
Послідовність амінокислотних залишків у пептидному ланцюзі можна розглядати як форму запису інформації. Ця інформація визначає просторове укладання лінійного пептидного ланцюга більш компактну тривимірну структуру, звану конформацієюбілка. Процес формування функціонально активної конформації білка має назву фолдинг.
4. Конформація білків.Вільне обертання в пептидному кістяку можливе між атомом азоту пептидної групи і сусіднім α-вуглецевим атомом, а також між α-вуглецевим атомом і вуглецем карбонільної групи. Внаслідок взаємодії функціональних груп амінокислотних залишків первинна структура білків може набувати складніших просторових структур. У глобулярних білках розрізняють два основні рівні укладання конформації пептидних ланцюгів: вториннуі третинну структуру.
Вторинна структура білків- це просторова структура, що формується в результаті утворення водневих зв'язків між функціональними групами -С=О і - NH- пептидного кістяка. При цьому пептидний ланцюг може набувати регулярних структур двох типів: α-спіраліі β-структури.
У α-спіраліводневі зв'язки утворюються між атомом кисню карбонільної групи та воднем амідного азоту 4-ї від нього амінокислоти; бічні ланцюги амінокислотних залишків
розташовуються по периферії спіралі, беручи участь у освіті вторинної структури (рис. 1.3.).
Об'ємні радикали або радикали, що несуть однакові заряди, перешкоджають формуванню α-спіралі. Залишок проліну, що має кільцеву структуру, перериває α-спіраль, оскільки через відсутність водню в атома азоту в пептидному ланцюзі неможливо утворити водневий зв'язок. Зв'язок між азотом і α-вуглецевим атомом входить до складу циклу проліну, тому пептидний кістяк у цьому місці набуває вигину.
β-Структураформується між лінійними областями пептидного остова одного поліпептидного ланцюга, утворюючи при цьому складчасті структури. Поліпептидні ланцюги або їх частини можуть формувати паралельніабо антипаралельні β-структури.У першому випадку N- і С-кінці взаємодіючих пептидних ланцюгів збігаються, а в другому мають протилежний напрямок (рис. 1.4).
Мал. 1.3. Вторинна структура білка - α-спіраль
 Мал. 1.4. Паралельні та антипаралельні β-складчасті структури
Мал. 1.4. Паралельні та антипаралельні β-складчасті структури
β-структури позначені широкими стрілками: А – Антипаралельна β-структура. Б - Паралельні β-складчасті структури
У деяких білках β-структури можуть формуватися за рахунок утворення водневих зв'язків між атомами пептидного кістяка різних поліпептидних ланцюгів.
У білках також зустрічаються області з нерегулярною вторинноюструктурою, до яких відносять вигини, петлі, повороти поліпептидного кістяка. Вони часто розташовуються в місцях, де змінюється напрямок пептидного ланцюга, наприклад, при формуванні паралельної β-складчастої структури.
За наявності α-спіралей та β-структур глобулярні білки можуть бути поділені на чотири категорії.
Мал. 1.5. Вторинна структура міоглобіну (А) та β-ланцюга гемоглобіну (Б), що містять вісім α-спіралей

 Мал. 1.6. Вторинна структура тріозофосфатизомерази та домену піруваткинази
Мал. 1.6. Вторинна структура тріозофосфатизомерази та домену піруваткинази
 Мал. 1.7. Вторинна структура константного домену імуноглобуліну (А) та ферменту супероксиддисмутази (Б)
Мал. 1.7. Вторинна структура константного домену імуноглобуліну (А) та ферменту супероксиддисмутази (Б)
У четверту категоріювключені білки, що мають у своєму складі незначну кількість регулярних вторинних структур. До таких білків можна віднести невеликі, багаті на цистеїн білки або металопротеїни.
Третинна структура білкатип конформації, що утворюється за рахунок взаємодій між радикалами амінокислот, які можуть перебувати на значній відстані один від одного в пептидному ланцюзі. Більшість білків у своїй формують просторову структуру, що нагадує глобулу (глобулярні білки).
Так як гідрофобні радикали амінокислот мають тенденцію до об'єднання за допомогою так званих гідрофобних взаємодійі міжмолекулярних ван-дер-ваальсових сил, усередині білкової глобули утворюється щільне ядро гідрофобне. Гідрофільні іонізовані та неіонізовані радикали в основному розташовуються на поверхні білка та визначають його розчинність у воді.
 Мал. 1.8. Типи зв'язків, що виникають між амінокислотними радикалами при формуванні третинної структури білка
Мал. 1.8. Типи зв'язків, що виникають між амінокислотними радикалами при формуванні третинної структури білка
1 - іонний зв'язок- виникає між позитивно та негативно зарядженими функціональними групами;
2 - водневий зв'язок- виникає між гідрофільною незарядженою та будь-якою іншою гідрофільною групою;
3 - гідрофобні взаємодії- виникають між гідрофобними радикалами;
4 - дисульфідний зв'язок- формується за рахунок окислення SH-груп залишків цистеїну та їх взаємодії один з одним
Гідрофільні амінокислотні залишки, що опинилися всередині гідрофобного ядра, можуть взаємодіяти один з одним за допомогою іоннихі водневих зв'язків(Рис. 1.8).
Іонні і водневі зв'язки, а також гідрофобні взаємодії належать до слабких: їх енергія ненабагато перевищує енергію теплового руху молекул при кімнатній температурі. Конформація білка підтримується за рахунок виникнення множини таких слабких зв'язків. Так як атоми, з яких складається білок, перебувають у постійному русі, то можливий розрив одних слабких зв'язків та утворення інших, що призводить до невеликих переміщень окремих ділянок поліпептидного ланцюга. Ця властивість білків змінювати конформацію в результаті розриву одних та утворення інших слабких зв'язків називається конформаційною лабільністю.
В організмі людини функціонують системи, що підтримують гомеостаз- сталість внутрішнього середовища у певних допустимих для здорового організму межах. У разі гомеостазу невеликі зміни конформації не порушують загальну структуру та функцію білків. Функціонально активна конформація білка називається нативною конформацією.Зміна внутрішнього середовища (наприклад, концентрації глюкози, іонів Са, протонів тощо) призводить до зміни конформації та порушення функцій білків.
Третинна структура деяких білків стабілізована дисульфідними зв'язками,що утворюються за рахунок взаємодії -SH груп двох залишків
 Мал. 1.9. Утворення дисульфідного зв'язку в молекулі білка
Мал. 1.9. Утворення дисульфідного зв'язку в молекулі білка
цистеїну (рис. 1.9). Більшість внутрішньоклітинних білків немає в третинної структурі ковалентних дисульфідних зв'язків. Їх наявність характерна для білків, що секретуються клітиною, що забезпечує їх велику стабільність у позаклітинних умовах. Так, дисульфідні зв'язки є в молекулах інсуліну та імуноглобулінів.
Інсулін- білковий гормон, що синтезується в β-клітинах підшлункової залози і секретується в кров у відповідь на підвищення концентрації глюкози в крові. У структурі інсуліну є два дисульфідні зв'язки, що з'єднують поліпептидні А- і В-ланцюги, і один дисульфідний зв'язок всередині А-ланцюга (рис. 1.10).
 Мал. 1.10. Дисульфідні зв'язки у структурі інсуліну
Мал. 1.10. Дисульфідні зв'язки у структурі інсуліну
5. Супервторинна структура білків.У різних за первинною структурою та функціями білках іноді виявляються подібні поєднання та взаєморозташування вторинних структур,які називаються супервторинною структурою. Вона займає проміжне положення між вторинною та третинною структурами, оскільки це специфічне поєднання елементів вторинної структури при формуванні третинної структури білка. Супервторинні структури мають специфічні назви, такі як "α-спіраль-поворот-а-спіраль", "лейцинова застібка блискавка", "цинкові пальці" та ін. Такі супервторинні структури характерні для ДНК-зв'язуючих білків.
«Лейцинова застібка-блискавка».Цей вид супервторинної структури використовується для з'єднання двох білків. На поверхні взаємодіючих білків є -спіральні ділянки, що містять не менше чотирьох залишків лейцину. Лейцинові залишки в -спіралі розташовуються через шість амінокислот один від одного. Так як кожен виток α-спіралі містить 3,6 амінокислотних залишків, радикали лейцину знаходяться на поверхні кожного другого витка. Лейцинові залишки -спіралі одного білка можуть взаємодіяти з лейциновими залишками іншого білка (гідрофобні взаємодії), з'єднуючи їх разом (рис. 1.11.). Багато ДНК білки, що зв'язують, функціонують у складі олігомерних комплексів, де окремі субодиниці зв'язуються один з одним «лейциновими застібками».
 Мал. 1.11. «Лейцинова застібка-блискавка» між α-спіральними ділянками двох білків
Мал. 1.11. «Лейцинова застібка-блискавка» між α-спіральними ділянками двох білків
Прикладом таких білків можуть бути гістони. Гістони- Ядерні білки, до складу яких входить велика кількістьпозитивно заряджених амінокислот - аргініну та лізину (до 80%). Молекули гістонів поєднуються в олігомерні комплекси, що містять вісім мономерів за допомогою «лейцинових застібок», незважаючи на значний однойменний заряд цих молекул.
«Цинковий палець»- варіант супервторинної структури, характерний для ДНК-зв'язуючих білків, має вигляд витягнутого фрагмента на поверхні білка та містить близько 20 амінокислотних залишків (рис. 1.12). Форму «витягнутого пальця» підтримує атом цинку, пов'язаний з радикалами чотири амінокислоти - два залишки цистеїну і два - гістидин. У деяких випадках замість залишків гістидину є залишки цистеїну. Два близько лежачих залишку цистеїну відокремлені від двох інших залишків Гісілі Ципоследовательностью, що складається приблизно з 12 амінокислотних залишків. Ця ділянка білка утворює -спіраль, радикали якої можуть специфічно зв'язуватися з регуляторними ділянками великої борозенки ДНК. Специфіка зв'язування індивідуального
 Мал. 1.12. Первинна структура ділянки ДНК-зв'язуючих білків, що формують структуру «цинкового пальця» (літерами позначені амінокислоти, що входять до складу цієї структури)
Мал. 1.12. Первинна структура ділянки ДНК-зв'язуючих білків, що формують структуру «цинкового пальця» (літерами позначені амінокислоти, що входять до складу цієї структури)
регуляторного ДНК-зв'язуючого білка залежить від послідовності амінокислотних залишків, розташованих у ділянці «цинкового пальця». Такі структури містять, зокрема, рецептори стероїдних гормонів, що беруть участь у регуляції транскрипції (зчитування інформації з ДНК на РНК)
ТЕМА 1.2. ОСНОВИ ФУНКЦІОНУВАННЯ БІЛКІВ. ЛІКИ ЯК ЛІГАНДИ, ЩО ВПЛИВАЮТЬ НА ФУНКЦІЮ БІЛКІВ
1. Активний центр білка та його взаємодія з лігандом.У процесі формування третинної структури лежить на поверхні функціонально активного білка, зазвичай, у поглибленні, утворюється ділянку, сформований радикалами амінокислот, далеко стоять друг від друга у первинної структурі. Ця ділянка, що має унікальну будову для даного білка і здатна специфічно взаємодіяти з певною молекулою або групою схожих молекул, називається центром зв'язування білка з лігандом або активним центром. Лігандами називаються молекули, що взаємодіють з білками.
Висока специфічністьвзаємодія білка з лігандом забезпечується комплементарністю структури активного центру структури ліганду.
Комплементарність- це просторова та хімічна відповідність взаємодіючих поверхонь. Активний центр повинен не тільки просторово відповідати ліганду, що входить до нього, а й між функціональними групами радикалів, що входять до активного центру, і лігандом повинні утворитися зв'язки (іонні, водневі, а також гідрофобні взаємодії), які утримують ліганд в активному центрі (рис. 1.13). ).
 Мал. 1.13. Комплементарна взаємодія білка з лігандом
Мал. 1.13. Комплементарна взаємодія білка з лігандом
Деякі ліганди, приєднуючись до активного центру білка, виконують допоміжну роль функціонуванні білків. Такі ліганди називаються кофакторами, а білки, що мають у своєму складі небілкову частину, - складними білками(На відміну від простих білків, що складаються тільки з білкової частини). Небілкова частина, міцно з'єднана з білком, має назву простетичної групи.Наприклад, у складі міоглобіну, гемоглобіну та цитохромів міститься міцно прикріплена до активного центру простетична група - гем, що містить іон заліза. Складні білки, які містять гем, називаються гемопротеїни.
При приєднанні до білків специфічних лігандів проявляється функція цих білків. Так, альбумін – найважливіший білок плазми крові – виявляє свою транспортну функцію, приєднуючи до активного центру гідрофобні ліганди, такі як жирні кислоти, білірубін, деякі ліки та ін. (рис. 1.14)
Лігандами, що взаємодіють з тривимірною структурою пептидного ланцюга, можуть бути не тільки низькомолекулярні органічні та неорганічні молекули, а й макромолекули:
ДНК (розглянуті вище приклади з ДНК-зв'язуючими білками);
полісахариди;
 Мал. 1.14. Взаємозв'язок генотипу та фенотипу
Мал. 1.14. Взаємозв'язок генотипу та фенотипу
Унікальна первинна структура білків людини, закодована в молекулі ДНК, у клітинах реалізується у вигляді унікальної конформації, структури активного центру та функцій білків
У цих випадках білок дізнається певну ділянку ліганду, пропорційний і комплементарний центру зв'язування. Так, на поверхні гепатоцитів є білки-рецептори до гормону інсуліну, що має також білкову будову. Взаємодія інсуліну з рецептором викликає зміну його конформації та активації сигнальних систем, що призводять до запасання гепатоцитів поживних речовин після їжі.
Таким чином, в основі функціонування білків лежить специфічна взаємодія активного білкового центру з лігандом.
2. Доменна структура та її роль у функціонуванні білків.Довгі поліпептидні ланцюги глобулярних білків часто складаються у кілька компактних, щодо незалежних областей. Вони мають самостійну третинну структуру, що нагадує таку у глобулярних білків, і називаються доменів.Завдяки доменній структурі білків легше формується їхня третинна структура.
У доменних білках центри зв'язування з лігандом часто розташовуються між доменами. Так, трипсин – протеолітичний фермент, який виробляється екзокринною частиною підшлункової залози та необхідний для перетравлення білків їжі. Він має дводоменну будову, а центр зв'язування трипсину з його лігандом – харчовим білком – розташовується у борозенці між двома доменами. В активному центрі створюються умови, необхідні ефективного зв'язування специфічного ділянки харчового білка і гідролізу його пептидних зв'язків.
p align="justify"> Різні домени в білку при взаємодії активного центру з лігандом можуть переміщатися один щодо одного (рис. 1.15).
Гексокіназа- Фермент, що каталізує фосфорилювання глюкози за допомогою АТФ. Активний центр ферменту знаходиться в ущелині між двома доменами. При зв'язуванні гексокінази з глюкозою навколишні домени замикаються і субстрат виявляється в «пастці», де і відбувається фосфорилювання (див. рис. 1.15).
 Мал. 1.15. Зв'язування доменів гексокінази з глюкозою
Мал. 1.15. Зв'язування доменів гексокінази з глюкозою
У деяких білках домени виконують самостійні функції, зв'язуючись із різними лігандами. Такі білки називаються функціональними.
3. Ліки – ліганди, що впливають на функцію білків.Взаємодія білків із лігандами специфічно. Однак завдяки конформаційній лабільності білка та його активного центру можна підібрати іншу речовину, яка могла б взаємодіяти з білком в активному центрі або іншій ділянці молекули.
Речовина, що за структурою схожа на природний ліганд, називають структурним аналогом лігандучи неприродним лігандом. Воно також взаємодіє з білком у активному центрі. Структурний аналог ліганду може посилювати функцію білка. (агоніст),так і знижувати її (антагоніст).Ліганд та його структурні аналоги конкурують один з одним за зв'язування з білком в одному центрі. Такі речовини називаються конкурентними модуляторами(Регуляторами) білкових функцій. Багато лікарські засобидіють як інгібітори білків. Деякі їх отримують хімічної модифікацією природних лігандів. Інгібітори білкових функцій можуть бути ліками та отрутами.
Атропін – конкурентний інгібітор М-холінорецепторів.Ацетилхолін - нейромедіатор передачі нервового імпульсу через холінергічні синапси. Для проведення збудження ацетилхолін, що виділився в синаптичну щілину, повинен взаємодіяти з білком - рецептором постсинаптичної мембрани. Виявлено два типи холінорецепторів:
М-рецептор,крім ацетилхоліну вибірково взаємодіє з мускарином (токсином мухомора). М - холінорецептори є на гладких м'язах і при взаємодії з ацетилхолін викликають їх скорочення;
Н-рецептор,що специфічно зв'язується з нікотином. Н-холінорецептори виявлені в синапсах поперечносмугастих скелетних м'язів.
Специфічним інгібітором М-холінорецепторівє атропін. Він міститься в рослинах беладони і білі.
 Атропін має в структурі схожі з ацетилхоліном функціональні групи та їхнє просторове розташування, тому відноситься до конкурентних інгібіторів М-холінорецепторів. Враховуючи, що зв'язування ацетилхоліну з М-холінорецепторами викликає скорочення гладких м'язів, атропін використовують як ліки, що знімають їх спазм. (Спазмолітик).Так, відомо застосування атропіну для розслаблення м'язів очних при перегляді очного дна, а також для зняття спазмів при шлунково-кишкових коліках. М-холінорецептори є і в центральній нервової системи(ЦНС), тому великі дози атропіну можуть спричинити небажану реакцію з боку ЦНС: рухове та психічне збудження, галюцинації, судоми.
Атропін має в структурі схожі з ацетилхоліном функціональні групи та їхнє просторове розташування, тому відноситься до конкурентних інгібіторів М-холінорецепторів. Враховуючи, що зв'язування ацетилхоліну з М-холінорецепторами викликає скорочення гладких м'язів, атропін використовують як ліки, що знімають їх спазм. (Спазмолітик).Так, відомо застосування атропіну для розслаблення м'язів очних при перегляді очного дна, а також для зняття спазмів при шлунково-кишкових коліках. М-холінорецептори є і в центральній нервової системи(ЦНС), тому великі дози атропіну можуть спричинити небажану реакцію з боку ЦНС: рухове та психічне збудження, галюцинації, судоми.
Дитилін - конкурентний агоніст Н-холінорецепторів, що інгібує функцію нервово-м'язових синапсів.
 Нервово-м'язові синапси скелетних м'язів містять Н-холінорецептори. Їхня взаємодія з ацетилхоліном призводить до м'язових скорочень. При деяких хірургічних операціях, а також в ендоскопічних дослідженнях використовують препарати, що спричиняють розслаблення кістякових м'язів. (Міорелаксанти).До них відноситься дитилін, що є структурним аналогом ацетилхоліну. Він приєднується до Н-холінорецепторів, але на відміну від ацетилхоліну дуже повільно руйнується ферментом - ацетилхолінестеразою. Внаслідок тривалого відкриття іонних каналів та стійкої деполяризації мембрани порушується проведення нервового імпульсу та відбувається м'язове розслаблення. Спочатку ці властивості були виявлені у отрути кураре, тому такі препарати називають курареподібними.
Нервово-м'язові синапси скелетних м'язів містять Н-холінорецептори. Їхня взаємодія з ацетилхоліном призводить до м'язових скорочень. При деяких хірургічних операціях, а також в ендоскопічних дослідженнях використовують препарати, що спричиняють розслаблення кістякових м'язів. (Міорелаксанти).До них відноситься дитилін, що є структурним аналогом ацетилхоліну. Він приєднується до Н-холінорецепторів, але на відміну від ацетилхоліну дуже повільно руйнується ферментом - ацетилхолінестеразою. Внаслідок тривалого відкриття іонних каналів та стійкої деполяризації мембрани порушується проведення нервового імпульсу та відбувається м'язове розслаблення. Спочатку ці властивості були виявлені у отрути кураре, тому такі препарати називають курареподібними.
ТЕМА 1.3. ДЕНАТУРАЦІЯ БІЛКІВ І МОЖЛИВІСТЬ ЇХ СПОНТАННОЇ РЕНАТИВАЦІЇ
1. Так як нативна конформація білків підтримується за рахунок слабких взаємодій, зміна складу і властивостей навколишнього середовища, вплив хімічних реагентів і фізичних факторіввикликають зміну їхньої конформації (властивість конформаційної лабільності). Розрив великої кількості зв'язків призводить до руйнування нативної конформації та денатурації білків.
Денатурація білків- це руйнування їх нативної конформації під дією агентів, що денатурують, викликане розривом слабких зв'язків, що стабілізують просторову структуру білка. Денатурація супроводжується руйнуванням унікальної тривимірної структури та активного центру білка та втратою його біологічної активності (рис. 1.16).
Всі денатуровані молекули одного білка набувають випадкової конформації, яка відрізняється від інших молекул того ж білка. Радикали амінокислот, формують активний центр, виявляються просторово віддаленими друг від друга, тобто. руйнується специфічний центр зв'язування білка з лігандом. При денатурації первинна структура білків залишається постійною.
Застосування денатуруючих агентів у біологічних дослідженнях та медицині.У біохімічних дослідженнях перед визначенням біологічному матеріалі низькомолекулярних сполук зазвичай з розчину спочатку видаляють білки. Для цієї мети найчастіше використовують трихлороцтову кислоту (ТХУ). Після додавання ТХУ розчин денатуровані білки випадають в осад і легко видаляються фільтруванням (табл. 1.1.)
У медицині денатуруючі агенти часто застосовують для стерилізації медичного інструменту і матеріалу в автоклавах (денатуруючий агент - висока температура) і як антисептики (спирт, фенол, хлорамін) для обробки забруднених поверхонь, що містять патогенну мікрофлору.
2. Спонтанна ренативація білків- доказ детермінованості первинної структури, конформації та функції білків. Індивідуальні білки - це продукти одного гена, які мають ідентичну амінокислотну послідовність і в клітині набувають однакової конформації. Фундаментальний висновок про те, що в первинній структурі білка вже закладена інформація про його конформацію та функції, було зроблено на основі здатності деяких білків (зокрема, рибонуклеази та міоглобіну) до спонтанної ренативації – відновлення їхньої нативної конформації після денатурації.
Формування просторових структур білка здійснюється способом самоскладання - мимовільного процесу, при якому поліпептидний ланцюг, що має унікальну первинну структуру, прагне прийняти в розчині конформацію з найменшою вільною енергією. Здатність до ренативації білків, що зберігають після денатурації первинну структуру, описана у досліді з ферментом рибонуклеазою.
Рибонуклеаза – фермент, що руйнує зв'язки між окремими нуклеотидами в молекулі РНК. Цей глобулярний білок має один поліпептидний ланцюг, третинна структура якого стабілізована безліччю слабких та чотирма дисульфідними зв'язками.
Обробка рибонуклеази сечовиною, що руйнує водневі зв'язки в молекулі, та відновником, що розриває дисульфідні зв'язки, призводить до денатурації ферменту та втрати його активності.
Видалення денатуруючих агентів діалізом призводить до відновлення конформації та функції білка, тобто. до ренативації. (Рис. 1.17).
 Мал. 1.17. Денатурація та ренативація рибонуклеази
Мал. 1.17. Денатурація та ренативація рибонуклеази
А - нативна конформація рибонуклеази, в третинній структурі якої є чотири дисульфідні зв'язки; Б – денатурована молекула рибонуклеази;
В - ренативована молекула рибонуклеази з відновленою структурою та функцією
1. Заповніть таблицю 1.2.
Таблиця 1.2. Класифікація амінокислот за полярністю радикалів
2. Напишіть формулу тетрапептиду:
Асп - Про - Фен - Ліз
а) виділіть у пептиді повторювані групи, що утворюють пептидний кістяк, і варіабельні групи, представлені радикалами амінокислот;
б) позначте N- та С-кінці;
в) підкресліть пептидні зв'язки;
г) напишіть інший пептид, що складається з тих самих амінокислот;
д) підрахуйте кількість можливих варіантівтетрапептиду з аналогічним амінокислотним складом.
3. Поясніть роль первинної структури білків на прикладі порівняльного аналізу двох подібних за структурою та еволюційно близьких пептидних гормонів нейрогіпофіза ссавців – окситоцину та вазопресину (табл. 1.3).
Таблиця 1.3. Структура та функції окситоцину та вазопресину
 Для цього:
Для цього:
а) порівняйте склад та послідовність амінокислот двох пептидів;
б) знайдіть подібність первинної структури двох пептидів та подібність їх біологічної дії;
в) знайдіть відмінності у структурі двох пептидів та відмінність їх функцій;
г) зробіть висновок вплив первинної структури пептидів з їхньої функції.
4. Опишіть основні етапи формування конформації глобулярних білків (вторинна, третинна структури, поняття супервторинної структурі). Вкажіть типи зв'язків, що у формуванні структур білка. Радикали яких амінокислот можуть брати участь у освіті гідрофобних взаємодій, іонних, водневих зв'язках.
Наведіть приклади.
5. Дайте визначення поняття «конформаційна лабільність білків», вкажіть причини її існування та значення.
6. Розкрийте зміст наступної фрази: «В основі функціонування білків лежить їхня специфічна взаємодія з лігандом», використовуючи терміни та пояснюючи їх значення: конформація білка, активний центр, ліганд, комплементарність, функція білка.
7. На одному з прикладів поясніть, що таке домени та яка їхня роль у функціонуванні білків.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Встановіть відповідність.
Функціональна група в радикалі амінокислоти:
А. Карбоксильна група Б. Гідроксильна група В Гуанідінова група Г. Тіольна група Д. Аміногрупа
2. Виберіть правильні відповіді.
Амінокислоти з полярними незарядженими радикалами – це:
A. Цис Б. Асн
B. Глу Г. Три
3. Виберіть правильні відповіді.
Радикали амінокислот:
A. Забезпечують специфічність первинної структури Б. Беруть участь у формуванні третинної структури
B. Розташовуючись на поверхні білка, впливають на його розчинність Г. Формують активний центр
Д. Беруть участь у освіті пептидних зв'язків
4. Виберіть правильні відповіді.
Гідрофобні взаємодії можуть утворюватися між амінокислотними радикалами:
A. Тре Лей Б. Про Три
B. Мет Іле Г. Тір Ала Д. Вал Фен
5. Виберіть правильні відповіді.
Іонні зв'язки можуть утворюватися між радикалами амінокислот:
A. Глн Асп Б. Apr Ліз
B. Ліз Глу Г. Гіс Асп Д. Асн Apr
6. Виберіть правильні відповіді.
Водневі зв'язки можуть утворюватися між радикалами амінокислот:
A. Сер Глн Б. Ціс Тре
B. Асп Ліз Г. Глу Асп Д. Асн Тре
7. Встановіть відповідність.
Тип зв'язку, що бере участь у формуванні структури білка:
A. Первинна структура Б. Вторинна структура
B. Третинна структура
Р. Супервторинна структура Д. Конформація.
1. Водневі зв'язки між атомами пептидного кістяка
2. Слабкі зв'язки між функціональними групами радикалів амінокислот
3. Зв'язки між α-аміно та α-карбоксильними групами амінокислот
8. Виберіть правильні відповіді. Трипсин:
A. Протеолітичний фермент Б. Містить два домени
B. Гідролізує крохмаль
Активний центр розташований між доменами. Д. Складається із двох поліпептидних ланцюгів.
9. Виберіть правильні відповіді. Атропін:
A. Нейромедіатор
Б. Структурний аналог ацетилхоліну
B. Взаємодіє з Н-холінорецепторами
Г. Підсилює проведення нервового імпульсу через холінергічні синапси
Д. Конкурентний інгібітор М-холінорецепторів
10. Виберіть правильні твердження. У білках:
A. Первинна структура містить інформацію про будову його активного центру
Б. Активний центр формується лише на рівні первинної структури
B. Конформація жорстко фіксована ковалентними зв'язками
Г. Активний центр може взаємодіяти із групою схожих лігандів
завдяки конформаційній лабільності білків Д. Зміна довкілля, може впливати на спорідненість активного
центру до ліганду
1. 1-В, 2-Г, 3-Б.
3. А, Б, У, Р.
7. 1-Б, 2-Д, 3-А.
8. А, Б, У, Р.
ОСНОВНІ ТЕРМІНИ І ПОНЯТТЯ
1. Білок, поліпептид, амінокислоти
2. Первинна, вторинна, третинна структури білка
3. Конформація, нативна конформація білка
4. Ковалентні та слабкі зв'язки у білку
5. Конформаційна лабільність
6. Активний центр білка
7. Ліганди
8. Фолдинг білків
9. Структурні аналоги лігандів
10. Доменні білки
11. Прості та складні білки
12. Денатурація білка, агенти, що денатурують
13. Ренативація білків
Розв'яжіть завдання
«Структурна організація білків та основи їх функціонування»
1. Основна функція білка – гемоглобіну А (НвА) – транспорт кисню до тканин. У популяції людей відомі множинні форми цього білка із зміненими властивостями та функцією – так звані аномальні гемоглобіни. Наприклад, встановлено, що гемоглобін S, виявлений в еритроцитах хворих на серповидно-клітинну анемію (HbS), має низьку розчинність в умовах низького парціального тиску кисню (як це має місце у венозній крові). Це призводить до утворення агрегатів цього білка. Білок втрачає свою функцію, випадає в осад, а еритроцити набувають неправильної форми (деякі з них утворюють форму серпа) і швидше, ніж звичайно, руйнуються в селезінці. В результаті розвивається серповидноклітинна анемія.
Єдина відмінність у первинній структурі НВА і виявлена в N-кінцевій ділянці β-ланцюга гемоглобіну. Порівняйте N-кінцеві ділянки β-ланцюга та покажіть, як зміни у первинній структурі білка впливають на його властивості та функції.
 Для цього:
Для цього:
а) напишіть формули амінокислот, якими розрізняються НвА і порівняйте властивості цих амінокислот (полярність, заряд).
б) зробіть висновок про причину зниження розчинності та порушення транспорту кисню в тканині.
2. На малюнку представлено схему будови білка, що має центр зв'язування з лігандом (активний центр). Поясніть, чому білок має вибірковість у виборі ліганду. Для цього:
а) пригадайте, що таке активний центр білка, та розгляньте будову активного центру білка, представленого на малюнку;
б) напишіть формули радикалів амінокислот, що входять до складу активного центру;
в) намалюйте ліганд, який міг би взаємодіяти з активним центром білка. Вкажіть у ньому функціональні групи, здатні утворити зв'язки України із радикалами амінокислот, які входять до складу активного центру;
г) вкажіть типи зв'язків, що виникають між лігандом та радикалами амінокислот активного центру;
д) поясніть, на чому ґрунтується специфічність взаємодії білка з лігандом.
 3.
На малюнку представлений активний центр білка та кілька лігандів.
3.
На малюнку представлений активний центр білка та кілька лігандів.
Визначте, який із лігандів з найбільшою ймовірністю взаємодіятиме з активним центром білка і чому.
 Які типи зв'язків виникають у процесі утворення комплексу «білок-ліганд»?
Які типи зв'язків виникають у процесі утворення комплексу «білок-ліганд»?
4. Структурні аналоги природних лігандів білків можуть використовуватися як лікарські препарати для зміни активності білків.
Ацетилхолін – медіатор передачі збудження в нервово-м'язових синапсах. При взаємодії ацетилхоліну з білками – рецепторами постсинаптичної мембрани кістякових м'язів відбувається відкриття іонних каналів та м'язове скорочення. Дитилін - ліки, що застосовуються при деяких операціях для розслаблення м'язів, оскільки він порушує передачу нервового імпульсу через нервово-м'язові синапси. Поясніть механізм дії дитиліну як міорелаксуючого препарату. Для цього:
а) напишіть формули ацетилхоліну та дитиліну та порівняйте їх структури;
б) опишіть механізм розслаблюючої дії дитиліну.
5. При деяких захворюваннях хворого підвищується температура тіла, що розглядають як захисну реакцію організму. Однак високі температури є згубними для білків організму. Поясніть, чому при температурі вище 40 °С порушується функція білків і виникає загроза життю людини. Для цього згадайте:
1) Будова білків та зв'язку, що утримують його структуру в нативній конформації;
2) Як змінюється структура та функція білків при підвищенні температури?;
3) Що таке гомеостаз і чому він важливий підтримки здоров'я людини.
Модульна одиниця 2 ОЛІГОМІРНІ БІЛКИ ЯК МИШЕННЯ РЕГУЛЯТОРНИХ ВПЛИВ. СТРУКТУРНО-ФУНКЦІОНАЛЬНА БАГАТООБРАЗЯ БІЛКІВ. МЕТОДИ РОЗДІЛУ ТА ОЧИЩЕННЯ БІЛКІВ
Цілі вивчення Вміти:
1. Використовувати знання про особливості структури та функції олігомерних білків для розуміння адаптивних механізмів регуляції їх функцій.
2. Пояснювати роль шаперонів у синтезі та підтримці конформації білків в умовах клітини.
3. Пояснювати різноманіття прояви життя різноманіттям структур та функцій білків, що синтезуються в організмі.
4. Аналізувати зв'язок структури білків з їхньою функцією на прикладах порівняння споріднених гемопротеїнів - міоглобіну та гемоглобіну, а також представників п'яти класів білків сімейства імуноглобулінів.
5. Застосовувати знання про особливості фізико-хімічних властивостей білків для вибору методів їхнього очищення від інших білків та домішок.
6. Інтерпретувати результати кількісного та якісного складубілків плазми для підтвердження або уточнення клінічного діагнозу.
Знати:
1. Особливості будови олігомерних білків та адаптивні механізми регуляції їх функцій на прикладі гемоглобіну.
2. Будова та функції шаперонів та їх значення для підтримки нативної конформації білків в умовах клітини.
3. Принципи об'єднання білків у сімейства за схожістю їхньої конформації та функцій на прикладі імуноглобулінів.
4. Методи поділу білків, що ґрунтуються на особливостях їх фізикохімічних властивостей.
5. Електрофорез плазми крові як метод оцінки якісного та кількісного складу білків.
ТЕМА 1.4. ОСОБЛИВОСТІ БУДУВАННЯ ТА ФУНКЦІОНУВАННЯ ОЛІГОМІРНИХ БІЛКІВ НА ПРИКЛАДІ ГЕМОГЛОБІНУ
1. Багато білків мають у своєму складі кілька поліпептидних ланцюгів. Такі білки називають олігомірними,а окремі ланцюги - протомірами.Протоміри в олігомерних білках з'єднані безліччю слабких нековалентних зв'язків (гідрофобних, іонних, водневих). Взаємодія
протомірів здійснюється завдяки комплементарностіїх поверхонь, що контактують.
Кількість протомерів в олігомерних білках може сильно варіювати: гемоглобін містить 4 протоміри, фермент аспартатамінотрансферазу - 12 протомірів, а в білок вірусу тютюнової мозаїки входить 2120 протомірів, з'єднаних нековалентними зв'язками. Отже, олігомерні білки можуть мати дуже велику молекулярну масу.
Взаємодія одного протомера з іншими можна розглядати як окремий випадок взаємодії білка з лігандом, тому що кожен протомір служить лігандом для інших протомірів. Кількість та спосіб з'єднання протомерів у білку називається четвертинною структурою білка.
До складу білків можуть входити однакові або різні за будовою протоміри, наприклад, гомодімери - білки, що містять два однакових протоміри, а гетеродимери - білки, що містять два різні протоміри.
Якщо до складу білків входять різні протомери, то на них можуть формуватися центри зв'язування, що відрізняються за структурою, з різними лігандами. При зв'язуванні ліганду з активним центром проявляється функція білка. Центр, розташований на іншому протомірі, називається алостеричним (іншим, відмінним від активного). Зв'язуючись з алостеричним лігандом або ефектором,він виконує регуляторну функцію (рис. 1.18). Взаємодія алостеричного центру з ефектором викликає конформаційні зміни у структурі всього олигомерного білка завдяки його конформаційної лабільності. Це впливає на спорідненість активного центру до специфічного ліганду та регулює функцію цього білка. Зміна конформації та функції всіх протомерів при взаємодії олігомерного білка хоча б з одним лігандом зветься кооперативних змін конформації. Ефектори, що підсилюють функцію білка, називаються активаторами,а ефектори, що пригнічують його функцію, - інгібіторами.
Таким чином, у олігомерних білків, а також білків, що мають доменну будову, з'являється нова порівняно з мономерними білками властивість - здатність до алостеричної регуляції функцій (регуляції приєднанням до білка різних лігандів). Це можна простежити, порівнюючи структури та функції двох близьких споріднених складних білків міоглобіну та гемоглобіну.
 Мал. 1.18. Схема будови димерного білка
Мал. 1.18. Схема будови димерного білка
2. Формування просторових структур та функціонування міоглобіну.
Міоглобін (Мв) - білок, що знаходиться в червоних м'язах, основна функція якого - створення запасів О2, необхідних при інтенсивній м'язової роботи. Мв – складний білок, що містить білкову частину – апоМв та небілкову частину – гем. Первинна структура апоМв визначає його компактну глобулярну конформацію та структуру активного центру, до якого приєднується небілкова частина міоглобіну – гем. Кисень, що надходить із крові в м'язи, зв'язується з Fe+2 гема у складі міоглобіну. Мв - мономерний білок, що має дуже високу спорідненість до О 2 тому віддача кисню міоглобіном відбувається тільки при інтенсивній м'язовій роботі, коли парціальний тиск O 2 різко знижується.
Формування конформації Мв.У червоних м'язах на рибосомах в ході трансляції йде синтез первинної структури Мв, представленої специфічною послідовністю 153 залишків амінокислот. Вторинна структура Мв містить вісім α-спіралей, званих латинськими літерами від А до Н, між якими є неспіралізовані ділянки. Третинна структура Мв має вигляд компактної глобули, у поглибленні якої між F та Е α-спіралями розташований активний центр (рис. 1.19).
 Мал. 1.19. Структура міоглобіну
Мал. 1.19. Структура міоглобіну
3. Особливості будови та функціонування активного центру Мв.Активний центр Мв сформований переважно гідрофобними радикалами амінокислот, далеко віддаленими один від одного в первинній структурі (наприклад, Три 3 9 і Фен 138) До активного центру приєднується погано розчинні у воді ліганди - гем та О 2 . Гем - специфічний ліганд апоМв (рис. 1.20), основу якого складають чотири піррольні кільця, з'єднаних метенільними містками; в центрі розташований атом Fe+ 2 з'єднаний з атомами азоту піррольних кілець чотирма координаційними зв'язками. В активному центрі Мв крім гідрофобних радикалів амінокислот є залишки двох амінокислот з гідрофільними радикалами - Гіс Е 7(Гіс 64) та Гіс F 8(Гіс 93) (рис. 1.21).
 Мал. 1.20. Будова гема - небілкової частини міоглобіну та гемоглобіну
Мал. 1.20. Будова гема - небілкової частини міоглобіну та гемоглобіну
 Мал. 1.21. Розташування гема та O 2 в активному центрі апоміоглобіну та протомерів гемоглобіну
Мал. 1.21. Розташування гема та O 2 в активному центрі апоміоглобіну та протомерів гемоглобіну
Гем через атом заліза ковалентно пов'язаний із Гіс F 8 . O 2 приєднується до заліза з іншого боку поверхні гему. Гіс Е 7 необхідний для правильної орієнтації О 2 і полегшує приєднання кисню до Fe + 2 гема
Гіс F 8утворює координаційний зв'язок з Fe+2 та міцно фіксує гем в активному центрі. Гіс Е 7необхідний для правильної орієнтації в активному центрі іншого ліганду - O 2 за його взаємодії з Fe + 2 гема. Мікрооточення гема створює умови для міцного, але оборотного зв'язування O 2 з Fe +2 і перешкоджає попаданню в активний гідрофобний центр води, що може призвести до його окислення в Fе + 3 .
Мономірна будова Мв та його активного центру визначає високу спорідненість білка до О 2 .
4. Олігомірна будова Нв та регуляція спорідненості Нв до О 2 лігандами. Гемоглобіни людини- сімейство білків, так само як і міоглобін, що відносяться до складних білків (гемопротеїнів). Вони мають тетрамерну будову і містять два α-ланцюги, але розрізняються за будовою двох інших поліпептидних ланцюгів (2α-, 2х-ланцюга). Будова другого поліпептидного ланцюга визначає особливості функціонування цих форм НВ. Близько 98% гемоглобіну еритроцитів дорослої людини становить гемоглобін А(2α-, 2р-ланцюги).
У період внутрішньоутробного розвитку функціонують два основні типи гемоглобінів: ембріональний Нв(2α, 2ε), який виявляється на ранніх етапах розвитку плода, та гемоглобін F (фетальний)- (2α, 2γ), який приходить на зміну ранньому гемоглобіну плода на шостому місяці внутрішньоутробного розвитку і лише після народження заміщається на Нв А.
Нв А - білок, споріднений з міоглобіном (Мв), міститься в еритроцитах дорослої людини. Будова окремих протомерів аналогічна такому у міоглобіну. Вторинна і третинна структури міоглобіну і протомерів гемоглобіну дуже подібні, незважаючи на те, що в первинній структурі їх поліпептидних ланцюгів ідентичні тільки 24 амінокислотних залишку (вторинна структура протомірів гемоглобіну, так само як міоглобін, містить вісім α-спіралей до літер , А третинна структура має вигляд компактної глобули). Але на відміну від міоглобіну гемоглобін має олігомерну будову, що складається з чотирьох поліпептидних ланцюгів, з'єднаних нековалентними зв'язками (рис 1.22).
Кожен протомір Нв пов'язаний з небілковою частиною – гемом та сусідніми протомірами. З'єднання білкової частини Нв з гемом аналогічно такому у міоглобіну: в активному центрі білка гідрофобні частини гема оточені гідрофобними радикалами амінокислот за винятком Гіс F 8 і Гіс Е 7 , які розташовані по обидва боки від площини гема і відіграють аналогічну роль у функціонуванні його білка з киснем (див. будову міоглобіну).
 Мал. 1.22. Олігомірна структура гемоглобіну
Мал. 1.22. Олігомірна структура гемоглобіну
Крім того, Гіс Е 7виконує важливу додаткову рольу функціонуванні НВ. Вільний гем має у 25 000 разів більш високу спорідненість до СО, ніж О 2 . СО у невеликих кількостях утворюється в організмі і, враховуючи його високу спорідненість до гему, він міг би порушувати транспорт необхідного для життя клітин О2. Однак у складі гемоглобіну спорідненість гема до оксиду вуглецю перевищує спорідненість до 2 всього в 200 разів завдяки наявності в активному центрі Гіс Е 7 . Залишок цієї амінокислоти створює оптимальні умовидля зв'язування гему з O 2 і послаблює взаємодію гему з СО.
5. Основна функція Нв - транспорт Про 2 з легких у тканині.На відміну від мономерного міоглобіну, що має дуже високу спорідненість до 2 і виконує функцію запасання кисню в червоних м'язах, олігомірна структура гемоглобіну забезпечує:
1) швидке насичення Нв киснем у легенях;
2) здатність Нв віддавати кисень у тканинах при відносно високому парціальному тиску O 2 (20-40 мм рт. ст.);
3) можливість регуляції спорідненості Нв до О2.
6. Кооперативні зміни конформації протомерів гемоглобіну прискорюють зв'язування O 2 у легенях та віддачу його у тканині. У легенях високий парціальний тиск O 2 сприяє його зв'язування з Нв в активному центрі чотирьох протомерів (2α і 2β). Активний центр кожного протоміра, так само як і в міоглобіні, розташований між двома α-спіралями (F та Е) у гідрофобній кишені. Він містить небілкову частину - гем, прикріплений до білкової частини безліччю слабких гідрофобних взаємодій та одним міцним зв'язком між Fe 2 + гема та Гіс F 8 (див. рис. 1.21).
У дезоксигемоглобіні завдяки цьому зв'язку з Гіс F 8 атом Fe 2 + виступає з площини гема у напрямку до гістидину. Зв'язування O 2 з Fe 2 + відбувається з іншого боку гему області Гис Е 7 з допомогою єдиної вільної координаційного зв'язку. Гіс Е 7 забезпечує оптимальні умови для зв'язування O 2 із залізом гему.
Приєднання O 2 до атома Fe +2 одного протоміра викликає його переміщення в площину гема, а за ним і залишку гістидину, пов'язаного з ним
 Мал. 1.23. Зміна конформації протомера гемоглобіну при з'єднанні з O2
Мал. 1.23. Зміна конформації протомера гемоглобіну при з'єднанні з O2
Це призводить до зміни конформації всіх поліпептидних ланцюгів за рахунок їхньої конформаційної лабільності. Зміна конформації інших ланцюгів полегшує їх взаємодію Космосу з наступними молекулами Про 2 .
Четверта молекула О 2 приєднується до гемоглобіну у 300 разів легше, ніж перша (рис. 1.24).
 Мал. 1.24. Кооперативні зміни конформації протомерів гемоглобіну при його взаємодії з ПРО 2
Мал. 1.24. Кооперативні зміни конформації протомерів гемоглобіну при його взаємодії з ПРО 2
У тканинах кожна наступна молекула O 2 відщеплюється легше, ніж попередня, також з допомогою кооперативних змін конформації протомерів.
7. CO 2 і Н+, що утворюються при катаболізмі органічних речовин, зменшують спорідненість гемоглобіну до 2 пропорційно їх концентрації. Енергія, необхідна для роботи клітин, виробляється переважно в мітохондріях при окисленні органічних речовин з використанням O 2 , що доставляється з легких гемоглобіном. В результаті окислення органічних речовин утворюються кінцеві продукти їх розпаду: 2 і K 2 O, кількість яких пропорційно інтенсивності протікають процесів окислення.
2 дифузією потрапляє з клітин в кров і проникає в еритроцити, де під дією ферменту карбангідрази перетворюється на вугільну кислоту. Ця слабка кислота дисоціює на протон та бікарбонат іон.
Н+ здатні приєднатися до радикалів Гіс 14 6 в - і - ланцюгах гемоглобіну, тобто. у ділянках, віддалених від гему. Протонування гемоглобіну знижує його спорідненість до О 2 сприяє відщепленню О 2 від оксиНв, утворенню дезоксиНв і збільшує надходження кисню в тканини пропорційно кількості протонів, що утворилися (рис. 1.25).
Збільшення кількості звільненого кисню залежно від збільшення концентрації Н+ в еритроцитах називається ефектом Бора (на ім'я датського фізіолога Християна Бора, який вперше відкрив цей ефект).
У легенях високий парціальний тиск кисню сприяє його зв'язування з дезоксиНв, що зменшує спорідненість білка до Н+. Протони, що звільнилися, під дією карбангідрази взаємодіють з бікарбонатами з утворенням СО 2 і Н 2 О

 Мал. 1.25. Залежність спорідненості Нв до О 2 від концентрації 2 і протонів (ефект Бору):
Мал. 1.25. Залежність спорідненості Нв до О 2 від концентрації 2 і протонів (ефект Бору):
А- Вплив концентрації СО 2 і Н + на вивільнення Про 2 з комплексу з Нв (ефект Бору); Б- оксигенування дезоксигемоглобіну в легенях, утворення та виділення СО 2 .
СО 2, що утворився, надходить в альвеолярний простір і видаляється з повітрям, що видихається. Таким чином, кількість кисню, що вивільняється гемоглобіном, в тканинах регулюється продуктами катаболізму органічних речовин: чим інтенсивніше розпад речовин, наприклад при фізичних навантаженнях, тим вище концентрація СО 2 і Н + і тим більше кисню отримують тканини в результаті зменшення спорідненості Нв до О 2 .
8. Алостеричне регулювання спорідненості Нв до О 2 лігандом - 2,3-біс-фосфогліцератом.В еритроцитах з продукту окислення глюкози – 1,3-бісфосфогліцерату синтезується алостеричний ліганд гемоглобіну – 2,3-бісфосфогліцерат (2,3-БФГ). У нормальних умовах концентрація 2,3-БФГ висока та порівнянна з концентрацією Нв. 2,3-БФГ має сильний негативний заряд -5.
 Бісфосфогліцерат у капілярах тканин, зв'язуючись з дезоксигемоглобіном, збільшує вихід кисню в тканини, зменшуючи спорідненість Нв до О 2 .
Бісфосфогліцерат у капілярах тканин, зв'язуючись з дезоксигемоглобіном, збільшує вихід кисню в тканини, зменшуючи спорідненість Нв до О 2 .
У центрі тетрамерної молекули гемоглобіну є порожнина. Її утворюють амінокислотні залишки всіх чотирьох протомерів (див. рис. 1.22). У капілярах тканин протонування Нв (ефект Бору) призводить до розриву зв'язку між залізом гема та О 2 . У молекулі
дезоксигемоглобіну в порівнянні з оксигемоглобіном виникають додаткові іонні зв'язки, що з'єднують протомери, внаслідок чого розміри центральної порожнини в порівнянні з оксигемоглобіном збільшуються. Центральна порожнина є місцем приєднання 2,3-БФГ до гемоглобіну. Через різницю в розмірах центральної порожнини 2,3-БФГ може приєднуватися тільки до дезоксигемоглобіну.
2,3-БФГ взаємодіє з гемоглобіном в ділянці, віддаленій від активних центрів білка і відноситься до алостеричним(регуляторним) лігандам, а центральна порожнина Нв є алостеричним центром. 2,3-БФГ має сильний негативний заряд і взаємодіє з п'ятьма позитивно зарядженими групами двох β-ланцюгів Нв: N-кінцевою α-аміногрупою Вал і радикалами Ліз 82 Гіс 143 (рис. 1.26).
 Мал. 1.26. БФГ у центральній порожнині дезоксигемоглобіну
Мал. 1.26. БФГ у центральній порожнині дезоксигемоглобіну
БФГ зв'язується з трьома позитивно зарядженими групами у кожному β-ланцюзі.
У капілярах тканин дезоксигемоглобін, що утворюється, взаємодіє з 2,3-БФГ і між позитивно зарядженими радикалами β-ланцюгів і негативно зарядженим лігандом утворюються іонні зв'язки, які змінюють конформацію білка і знижують спорідненість Нв до О 2 . Зменшення спорідненості Нв до О 2 сприяє більш ефективному виходу О 2 тканини.
У легенях за високого парціального тиску кисень взаємодіє з Нв, приєднуючись до заліза гема; при цьому змінюється конформація білка, зменшується центральна порожнина та відбувається витіснення 2,3-БФГ з алостеричного центру
Таким чином, олігомерні білки мають нові порівняно з мономерними білками властивостями. Приєднання лігандів на ділянках,
просторово віддалених один від одного (алостеричних), здатне викликати конформаційні зміни у всій білковій молекулі. Завдяки взаємодії з регуляторними лігандами відбувається зміна конформації та адаптація функції білкової молекули до змін навколишнього середовища.
ТЕМА 1.5. ПІДТРИМАННЯ НАТИВНОЇ КОНФОРМАЦІЇ БІЛКІВ В УМОВАХ КЛІТИНИ
У клітинах у процесі синтезу поліпептидних ланцюгів, їх транспорту через мембрани у відповідні відділи клітини, у процесі фолдингу (формування нативної конформації) та при складанні олігомерних білків, а також у період їх функціонування у структурі білків виникають проміжні, схильні до агрегації. Гідрофобні радикали, в нативній конформації зазвичай заховані всередині білкової молекули, в нестабільній конформації опиняються на поверхні і прагнуть поєднання з такими ж погано розчинними у воді групами інших білків. У клітинах всіх відомих організмів виявлені спеціальні білки, які забезпечують оптимальний фолдинг білків клітини, стабілізують їхню нативну конформацію при функціонуванні і, що особливо важливо, підтримують структуру та функції внутрішньоклітинних білків при порушенні гомеостазу. Ці білки отримали назву «шаперони»,що у перекладі з французької означає «няня».
1. Молекулярні шаперони та їх роль у запобіганні денатурації білків.
Шаперони (Ш) класифікуються за масою субодиниць. Високомолекулярні шаперони мають масу від 60 до 110 кД. Серед них найбільш вивчені три класи: Ш-60, Ш-70 та Ш-90. Кожен клас включає сімейство родинних білків. Так, до складу Ш-70 входять білки з молекулярною масою від 66 до 78 кД. Низькомолекулярні шаперони мають молекулярну масу від 40 до 15 кД.
Серед шаперонів розрізняють конститутивнібілки, високий базальний синтез яких не залежить від стресових впливів на клітини організму, та індуцибельні,синтез яких у нормальних умовах йде слабко, але різко зростає при стресових впливах. Індуцибельні шаперони називають також «білками теплового шоку», оскільки вперше вони були виявлені в клітинах, які зазнавали впливу високих температур. У клітинах через високу концентрацію білків мимовільна ренативація частково денатурованих білків утруднена. Ш-70 можуть запобігати процесу денатурації, що почався, і сприяти відновленню нативної конформації білків. Молекулярні шаперони-70- Висококонсервативний клас білків, що знаходяться у всіх відділах клітини: цитоплазмі, ядрі, ендоплазматичному ретикулумі, мітохондріях. На карбоксильному кінці єдиного поліпептидного ланцюга Ш-70 є ділянка, яка є борозенкою, здатною взаємодіяти з пептидами довжиною
від 7 до 9 амінокислотних залишків, збагачених гідрофобними радикалами. Такі ділянки у глобулярних білках зустрічаються приблизно через кожні 16 амінокислот. Ш-70 здатні захищати білки від температурної інактивації та відновлювати конформацію та активність частково денатурованих білків.
2. Роль шаперонов у фолдингу білків.При синтезі білків на рибосомі N-кінцева область поліпептиду синтезується раніше С-кінцевої. Для формування нативної конформації потрібна повна амінокислотна послідовність білка. У процесі синтезу білків шаперони-70, завдяки будові активного центру, здатні закривати схильні до агрегації ділянки поліпептиду, збагачені гідрофобними радикалами амінокислот до завершення синтезу (рис 1.27, А).
 Мал. 1.27. Участь шаперонів у фолдингу білків
Мал. 1.27. Участь шаперонів у фолдингу білків
А - участь шаперонів-70 у запобіганні гідрофобних взаємодій між ділянками поліпептиду, що синтезується; Б - формування нативної конформації білка у шапероновому комплексі
Багато високомолекулярних білків, що мають складну конформацію, наприклад доменне будова, здійснюють фолдинг у спеціальному просторі, сформованому Ш-60. Ш-60функціонують у вигляді олігомерного комплексу, що складається з 14 субодиниць. Вони формують два порожнисті кільця, кожне з яких складається з семи субодиниць, ці кільця з'єднані один з одним. Кожна субодиниця Ш-60 складається з трьох доменів: апікального (верхівкового), збагаченого гідрофобними радикалами, зверненими в порожнину кільця, проміжного та екваторіального (рис. 1.28).
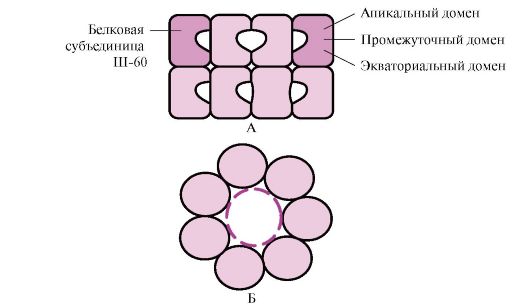 Мал. 1.28. Структура шаперонінового комплексу, що складається із 14 Ш-60
Мал. 1.28. Структура шаперонінового комплексу, що складається із 14 Ш-60
А – вид збоку; Б - вид зверху
Синтезовані білки, що мають на поверхні елементи, характерні для незгорнутих молекул, зокрема гідрофобні радикали, потрапляють у порожнину шаперонових кілець. У специфічному середовищі цих порожнин відбувається перебір можливих конформацій, доки знайдено єдина, енергетично найвигідніша (рис. 1.27, б). Формування конформацій та вивільнення білка супроводжується гідролізом АТФ в екваторіальній ділянці. Зазвичай такий шаперонозалежний фолдинг вимагає витрат значної кількості енергії.
Окрім участі у формуванні тривимірної структури білків та ренативації частково денатурованих білків, шаперони також необхідні для протікання таких фундаментальних процесів, як складання олігомерних білків, впізнавання та транспортування в лізосоми денатурованих білків, транспорт білків через мембрани, участь у регуляції активності білків.
ТЕМА 1.6. БАГАТООБРАЗЬ БІЛКІВ. СІМЕЙСТВА БІЛКІВ НА ПРИКЛАДІ ІМУНОГЛОБУЛІНІВ
1. Білки відіграють вирішальну роль у життєдіяльності окремих клітин і всього багатоклітинного організму, а їх функції напрочуд різноманітні. Це визначається особливостями первинної структури та конформацій білків, унікальністю будови активного центру та здатністю пов'язувати специфічні ліганди.
Лише невелика частина всіх можливих варіантів пептидних ланцюгів може прийняти стабільну просторову структуру; більшість
з них може приймати безліч конформацій з приблизно однаковою енергією Гіббса, але з різними властивостями. Первинна структура більшості відомих білків, відібраних біологічною еволюцією забезпечує виняткову стабільність однієї з конформацій, яка визначає особливості функціонування цього білка.
2. Сімейства білків.У межах одного біологічного виду заміни амінокислотних залишків можуть призводити до виникнення різних білків, що виконують споріднені функції та мають гомологічні послідовності амінокислот. Такі споріднені білки мають напрочуд подібні конформації: кількість і взаєморозташування α-спіралей та (або) β-структур, більшість поворотів і вигинів поліпептидних ланцюгів схожі або ідентичні. Білки з гомологічними ділянками поліпептидного ланцюга, подібною конформацією та спорідненими функціями виділяють у сімейства білків. Приклади сімейств білків: серинові протеїнази, сімейство імуноглобулінів, сімейство міоглобіну.
Серинові протеїнази- Сімейство білків, що виконують функцію протеолітичних ферментів. До них відносяться травні ферменти - хімотрипсин, трипсин, еластаза та багато факторів згортання крові. Ці білки мають у 40% положень ідентичні амінокислоти та дуже близьку конформацію (рис. 1.29).

Мал. 1.29. Просторові структури еластази (А) та хімотрипсину (Б)
Деякі амінокислотні заміни призвели до зміни субстратної специфічності цих білків та виникнення функціонального різноманіття усередині сімейства.
3. Сімейство імуноглобулінів.В роботі імунної системиВелику роль відіграють білки суперсімейства імуноглобулінів, що включає три сімейства білків:
Антитіла (імуноглобуліни);
Рецептори Т-лімфоцитів;
Білки головного комплексу гістосумісності - МНС 1-го та 2-го класів (Major Histocompatibility Complex).
Всі ці білки мають доменну будову, складаються з гомологічних імуноподібних доменів і виконують подібні функції: взаємодіють з чужорідними структурами або розчиненими в крові, лімфі або міжклітинної рідини (антитіла), або що знаходяться на поверхні клітин (власних або чужорідних).
4. Антитіла- специфічні білки, що виробляються В-лімфоцитами у відповідь на потрапляння в організм чужорідної структури, яка називається антигеном.
Особливості будови антитіл
Найпростіші молекули антитіл складаються з чотирьох поліпептидних ланцюгів: двох ідентичних легень - L, що містять близько 220 амінокислот, і двох ідентичних важких - Н, що складаються з 440-700 амінокислот. Усі чотири ланцюги в молекулі антитіла з'єднані безліччю нековалентних зв'язків та чотирма дисульфідними зв'язками (рис. 1.30).
Легкі ланцюги антитіла складаються з двох доменів: варіабельного (VL), що знаходиться в N-кінцевій області поліпептидного ланцюга, і константного (CL), розташованого на С-кінці. Тяжкі ланцюги зазвичай мають чотири домени: один варіабельний (VH), що знаходиться на N-кінці, і три константні (CH1, CH2, СНЗ) (див. рис. 1.30). Кожен домен імуноглобуліну має β-складчасту суперструктуру, в якій два залишки цистеїну з'єднані дисульфідним зв'язком.
Між двома константними доменами СН1 і СН2 є ділянка, що містить велику кількість залишків проліну, які перешкоджають формуванню вторинної структури та взаємодії сусідніх Н-ланцюгів на цьому відрізку. Ця шарнірна область надає молекулі антитіла гнучкість. Між варіабельними доменами важких і легких ланцюгів знаходяться дві ідентичні антигензв'язувальні ділянки (активні центри для зв'язування антигенів), тому такі антитіла часто називають бівалентами.У зв'язуванні антигену з антитілом бере участь не вся амінокислотна послідовність варіабельних ділянок обох ланцюгів, а лише 20-30 амінокислот, розташованих у гіперваріабельних областях кожного ланцюга. Саме ці галузі визначають унікальну здатністькожного виду антитіла взаємодіяти з відповідним комплементарним антигеном.
Антитіла - одна з ліній захисту організму проти чужорідних організмів, що впровадилися. Їх функціонування можна розділити на два етапи: перший етап - впізнавання та зв'язування антигену на поверхні чужорідних організмів, що можливе завдяки наявності в структурі антитіла антигензв'язуючих ділянок; другий етап - ініціація процесу інактивації та руйнування антигену. Специфіка другого етапу залежить від класу антитіл. Існує п'ять класів важких ланцюгів, що відрізняються один від одного за будовою константних доменів: α, δ, ε, γ і μ, відповідно до яких розрізняють п'ять класів імуноглобулінів: A, D, Е, G і М.
Особливості будови важких ланцюгів надають шарнірним ділянкам та С-кінцевим областям важких ланцюгів характерну для кожного класу конформацію. Після зв'язування антигену з антитілом конформаційні зміни доменів константних визначають шлях видалення антигену.
 Мал. 1. 30. Доменна будова IgG
Мал. 1. 30. Доменна будова IgG
Імуноглобуліни М
Імуноглобуліни М мають дві форми.
Мономірна форма- 1-й клас антитіл, що продукується В-лімфоцитом, що розвивається. Згодом багато В-клітин перемикаються на вироблення інших класів антитіл, але з тією ж ділянкою. IgM вбудовується в мембрану та виконує роль антигенрозпізнаючого рецептора. Вбудовування IgM в мембрану клітин можливе завдяки наявності хвостової частини ділянки 25 гідрофобних амінокислотних залишків.
Секреторна форма IgMмістить п'ять мономерних субодиниць, пов'язаних один з одним дисульфідними зв'язками та додатковою поліпептидною J-ланцюгом (рис. 1.31). Тяжкі ланцюги мономерів цієї форми не містять гідрофобної хвостової частини. Пентамер має 10 центрів зв'язування з антигеном і тому ефективний у розпізнаванні та видаленні антигену, що вперше потрапив в організм. Секреторна форма IgM – основний клас антитіл, що секретуються в кров при первинній імунній відповіді. Зв'язування IgM з антигеном змінює конформацію IgM та індукує зв'язування його з першим білковим компонентом системи комплементу (система комплементу - набір білків, що беруть участь у знищенні антигену) та активацію цієї системи. Якщо антиген розташований на поверхні мікроорганізму, система комплементу спричиняє порушення цілісності. клітинної мембранита загибель бактеріальної клітини.
Імуноглобуліни G
У кількісному відношенні цей клас імуноглобулінів переважає у крові (75% від усіх Ig). IgG – мономери, основний клас антитіл, що секретується в кров при вторинній імунній відповіді. Після взаємодії IgG з поверхневими антигенами мікроорганізмів комплекс антиген-антитіло здатний зв'язувати та активувати білки системи комплементу або може взаємодіяти з специфічними рецепторамимакрофагів та нейтрофілів. Взаємодія з фагоцитами наводить
 Мал. 1.31. Будова секреторної форми IgM
Мал. 1.31. Будова секреторної форми IgM
до поглинання комплексів антиген-антитіло та руйнування їх у фагосомах клітин. IgG – єдиний клас антитіл, які здатні проникати через плацентарний бар'єр та забезпечувати внутрішньоутробний захист плода від інфекцій.
Імуноглобуліни А
Основний клас антитіл, присутній у секретах (молоці, слині, секретах дихальних шляхів та кишечника). IgA секретуються переважно в димерній формі, де мономери пов'язані один з одним через додатковий J-ланцюг (рис. 1.32).
IgA не взаємодіють із системою комплементу та фагоцитуючими клітинами, але, зв'язуючись з мікроорганізмами, антитіла перешкоджають їх приєднанню до епітеліальних клітин та проникненню в організм.
Імуноглобуліни Е
Імуноглобуліни Е представлені мономерами, в яких важкі ε-ланцюги містять, так само як і μ-ланцюги імуноглобулінів М, один варіабельний і чотири константні домени. IgE після секреції зв'язуються своїми
 Мал. 1.32. Будова IgA
Мал. 1.32. Будова IgA
С-кінцевими ділянками з відповідними рецепторами на поверхні опасистих клітин та базофілів. В результаті вони стають рецепторами антигенів на поверхні даних клітин (рис. 1.33).
 Мал. 1.33. Взаємодія IgE з антигеном на поверхні опасистої клітини
Мал. 1.33. Взаємодія IgE з антигеном на поверхні опасистої клітини
Після того, як відбувається приєднання антигену до відповідних антигензв'язувальних ділянок IgE, клітини отримують сигнал до секреції біологічно активних речовин (гістаміну, серотоніну), які великою мірою відповідальні за розвиток запальної реакції та прояв таких алергічних реакцій, як астма, кропив'янка, сінна лихорад.
Імуноглобуліни D
Імуноглобуліни D виявлені у сироватці в дуже невеликій кількості, вони є мономерами. У важких δ-ланцюгах є один варіабельний і три константні домени. IgD виконують роль рецепторів В-лімфоцитів, інші функції поки що невідомі. Взаємодія специфічних антигенів з рецепторами на поверхні В-лімфоцитів (IgD) призводить до передачі цих сигналів у клітину та включення механізмів, що забезпечують розмноження даного клону лімфоцитів.
ТЕМА 1.7. ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ БІЛКІВ І МЕТОДИ ЇХ РОЗДІЛУ
1. Індивідуальні білки розрізняються за фізико-хімічними властивостями:
Форма молекул;
Молекулярну масу;
Сумарному заряду, величина якого залежить від співвідношення аніонних та катіонних груп амінокислот;
Співвідношенню полярних та неполярних радикалів амінокислот на поверхні молекул;
Ступені стійкості до дії різних агентів, що денатурують.
2. Розчинність білків залежитьвід властивостей білків, перерахованих вище, а також від складу середовища, в якому розчиняється білок (значення рН, сольового складу, температури, інших органічних речовин, здатних взаємодіяти з білком). Величина заряду білкових молекул - одне із чинників, які впливають їх розчинність. При втраті заряду в ізоелектричній точці білки легше агрегують і випадають в осад. Це особливо характерно для денатурованих білків, у яких на поверхні опиняються гідрофобні радикали амінокислот.
На поверхні білкової молекули є як позитивно, і негативно заряджені радикали амінокислот. Кількість цих груп, отже, і сумарний заряд білків залежить від рН середовища, тобто. співвідношення концентрації Н+- і ОН-груп. У кислому середовищіпідвищення концентрації Н+ призводить до придушення дисоціації карбоксильних груп -СОО - + Н+ > - СООН та зниження негативного зарядубілків. У лужному середовищі зв'язування надлишку ВІН - протонами, що утворюються при дисоціації аміногруп -NH 3 + + ВІН - - NH 2 + Н 2 Про утворення води, призводить до зменшення позитивного заряду білків. Значення рН, у якому білок має сумарний нульовий заряд, називається ізоелектричною точкою (ІЕТ).У ІЕТ число позитивно та негативно заряджених груп однаково, тобто. білок знаходиться у ізоелектричному стані.
3. Поділ індивідуальних білків.Особливості будови та функціонування організму залежать від набору білків, що синтезуються в ньому. Вивчення будови та властивостей білків неможливе без їх виділення з клітини та очищення від інших білків та органічних молекул. Стадії виділення та очищення індивідуальних білків:
Руйнування клітинтканини, що вивчається, і отримання гомогенату.
Розподіл гомогенату на фракціїцентрифугування, отримання ядерної, мітохондріальної, цитозольної або іншої фракції, що містить шуканий білок.
Виборча теплова денатурація- короткочасне нагрівання розчину білків, при якому можна видалити частину денатурованих білкових домішок (у разі, якщо білок відносно термостабілен).
Висолення.Різні білки випадають осад при різних концентраціях солі в розчині. Поступово підвищуючи концентрацію солі, можна отримати ряд окремих фракцій з переважним вмістом білка, що виділяється, в одній з них. Найчастіше для фракціонування білків використовують сульфат амонію. Білки з найменшою розчинністю випадають в осад при невеликих концентраціях солей.
Гель-фільтрація- метод просіювання молекул через набряклі гранули сефадекса (тривимірні полісахаридні ланцюги декстрану, що мають пори). Швидкість проходження білків через колонку, заповнену сефадексом, залежатиме від їхньої молекулярної маси: чим менше маса молекул білка, тим легше вони проникають усередину гранул і довше там затримуються, чим більше маса, тим швидше вони елююють з колонки.
Ультрацентрифугування- метод, який полягає в тому, що білки в центрифужній пробірці поміщають у ротор ультрацентрифуги. При обертанні ротора швидкість осідання білків пропорційна їхній молекулярній масі: фракції більш важких білків розташовані ближче до дна пробірки, легші - ближче до поверхні.
Електрофорез- метод, основу якого лежать розбіжності у швидкості руху білків в електричному полі. Ця величина пропорційна заряду білків. Електрофорез білків проводять на папері (у цьому випадку швидкість руху білків пропорційна тільки їхньому заряду) або в поліакриламідному гелі з певною величиною пор (швидкість руху білків пропорційна їхньому заряду та молекулярній масі).
Іонообмінна хроматографія- метод фракціонування, заснований на зв'язуванні іонізованих груп білків із протилежно зарядженими групами іонообмінних смол (нерозчинних) полімерних матеріалів). Міцність зв'язування білка із смолою пропорційна заряду білка. Білки, адсорбовані на іонообмінному полімері, можна змити розчинами NaCl із зростаючими концентраціями; що менше заряд білка, то менша концентрація NaCl знадобиться, щоб змити білок, пов'язані з іоногенними групами смоли.
Афінна хроматографія- Найбільш специфічний метод виділення індивідуальних білків. До інертного полімеру ковалентно приєднується ліганд будь-якого білка. При пропущенні розчину білків через колонку з полімером за рахунок комплементарного зв'язування білка з лігандом на колонці адсорбується лише специфічний для цього ліганду білок.
Діаліз- метод, що застосовується для видалення низькомолекулярних сполук з розчину білка, що виділяється. Метод заснований на нездатності білків проходити через напівпроникну мембрану на відміну низькомолекулярних речовин. Застосовується для очищення білків від низькомолекулярних домішок, наприклад, від солей після висолювання.
ЗАВДАННЯ ДЛЯ ПОЗААУДИТОРНОЇ РОБОТИ
1. Заповніть таблицю. 1.4.
Таблиця 1.4. Порівняльний аналізструктури та функцій споріднених білків - міоглобіну та гемоглобіну
а) згадайте будову активного центру Мв та НЬ. Яку роль грають гідрофобні радикали амінокислот у формуванні активних центрів цих білків? Опишіть будову активного центру Мв та НЬ та механізми приєднання до нього лігандів. Яку роль відіграють залишки Гіс F 8 та Гіс Е 7 у функціонуванні активного центру Мв і Нв?
б) які нові властивості в порівнянні з мономерним міоглобіном має близько споріднений олігомерний білок - гемоглобін? Поясніть роль кооперативних змін конформації протомерів у молекулі гемоглобіну, вплив концентрацій СО 2 та протонів на спорідненість гемоглобіну до кисню, а також роль 2,3-БФГ у алостеричній регуляції функції НЬ.
2. Дайте характеристику молекулярним шаперонам, звертаючи увагу зв'язок їх структури з функцією.
3. Які білки поєднують у сімейства? На прикладі сімейства імуноглобулінів визначте схожі риси будови та споріднені функції білків цього сімейства.
4. Часто для біохімічних та медичних цілей потрібні очищені індивідуальні білки. Поясніть, на яких фізико-хімічних властивостях білків засновані методи їх поділу та очищення, що використовуються.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Виберіть правильні відповіді.
Функції гемоглобіну:
A. Транспорт Про 2 з легких у тканини Б. Транспорт Н + із тканин у легені
B. Підтримка сталості рН крові Г. Транспорт СО 2 з легенів у тканині
Д. Транспорт СО 2 з тканин у легені
2. Виберіть правильні відповіді. Лігандомα -протоміру Нв є: A. Гем
Б. Кисень
B. СО Г. 2,3-БФГ
Д. β-протомір
3. Виберіть правильні відповіді.
Гемоглобін на відміну від міоглобіну:
A. Має четвертинну структуру
Б. Вторинна структура представлена лише α-спіралями
B. Належить до складних білків
Г. Взаємодіє з алостеричним лігандом Д. Ковалентно пов'язаний із гемом
4. Виберіть правильні відповіді.
Спорідненість Нв до О 2 зменшується:
A. При приєднанні однієї молекули ПРО 2 Б. При відщепленні однієї молекули ПРО 2
B. При взаємодії з 2,3-БФГ
Г. При приєднанні до протомірів Н+Д. При зниженні концентрації 2,3-БФГ
5. Встановіть відповідність.
Для типів Нв характерно:
A. У дезокси формі утворює фібрилярні агрегати Б. Містить у складі два α- та два δ-ланцюги
B. Переважна форма Нв в еритроцитах дорослої людини Г. В активному центрі містить гем з Fе+ 3
Д. Містить у складі два α- та два γ-ланцюга 1. НвА 2.
6. Встановіть відповідність.
Ліганди Нв:
A. Зв'язується з Нв в алостеричному центрі
Б. має дуже високу спорідненість до активного центру Нв
B. Приєднуючись, підвищує спорідненість Нв до O 2 Р. Окислює Fe+ 2 у Fе+ 3
Д. Утворює ковалентний зв'язок з гісF8
7. Виберіть правильні відповіді.
Шаперони:
A. Білки, присутні у всіх відділах клітини
Б. Синтез посилюється при стресових впливах
B. Беруть участь у гідролізі денатурованих білків
Г. Беруть участь у підтримці нативної конформації білків
Д. Створюють органели, у яких формується конформація білків
8. Встановіть відповідність. Імуноглобуліни:
A. Секреторна форма має пентамерну форму
Б. Клас Ig, що проникає через плацентарний бар'єр
B. Ig - рецептор опасистих клітин
Г. Основний клас Ig, присутніх у секретах епітеліальних клітин. Д. Рецептор В-лімфоцитів, активація якого забезпечує розмноження клітин
9. Виберіть правильні відповіді.
Імуноглобуліни Е:
A. Виробляються макрофагами Б. Мають важкі ланцюги.
B. Вбудовуються в мембрану Т-лімфоцитів
Г. Виконують роль мембранних рецепторів антигенів на опасистих клітинахта базофілах
Д. Відповідальні за прояв алергічних реакцій
10. Виберіть правильні відповіді.
Метод поділу білків заснований на відмінностях у їх молекулярній масі:
A. Гель-фільтрація
Б. Ультрацентрифугування
B. Електрофорез у поліакриламідному гелі Г. Іонообмінна хроматографія
Д. Афінна хроматографія
11. Виберіть правильну відповідь.
Метод поділу білків заснований на відмінностях у їх розчинності у воді:
A. Гель-фільтрація Б. Висолювання
B. Іонообмінна хроматографія Г. Афінна хроматографія
Д. Електрофорез у поліакриламідному гелі
ЕТАЛОНИ ВІДПОВІДЕЙ ДО «ЗАВАННЯМ ДЛЯ САМОКОНТРОЛЮ»
1. А, Б, В, Д
2. А, Б, В, Д
5. 1-В, 2-А, 3-Г
6. 1-В, 2-Б, 3-А
7. А, Б, Р, Д
8. 1-Г; 2-Б, 3-В
ОСНОВНІ ТЕРМІНИ І ПОНЯТТЯ
1. Олігомерні білки, протомір, четвертинна структура білків
2. Кооперативні зміни конформації протомірів
3. Ефект Бору
4. Алостеричне регулювання функцій білків, алостеричний центр та алостеричний ефектор
5. Молекулярні шаперони, білки теплового шоку
6. Сімейства білків (серинові протеази, імуноглобуліни)
7. IgM-, G-, Е-, А-зв'язок структури з функцією
8. Сумарний заряд білків, ізоелектрична точка білків
9. Електрофорез
10. Висолення
11. Гель-фільтрація
12. Іонообмінна хроматографія
13. Ультрацентрифугування
14. Афінна хроматографія
15. Електрофорез білків плазми
ЗАВДАННЯ ДЛЯ АУДИТОРНОЇ РОБОТИ
1. Порівняйте залежності ступенів насичення гемоглобіну (Нв) та міоглобіну (Mb) киснем від його парціального тиску в тканинах
 Мал. 1.34. Залежність насичення Мв іНЬкиснем від його парціального тиску
Мал. 1.34. Залежність насичення Мв іНЬкиснем від його парціального тиску
Зверніть увагу, що форма кривих насичення білків киснем різна: для міоглобіну – гіпербола, для гемоглобіну – сигмоїдна форма.
1. порівняйте значення парціального тиску кисню, у якому Мв і Нв насичені Про 2 на 50%. Який із цих білків характеризується вищою спорідненістю до О 2 ?
2. які особливості будови Мв визначають його високу спорідненість до О 2?
3. які особливості будови Нв дозволяють йому віддавати Про 2 в капілярах тканин, що спочивають (при відносно високому парціальному тиску Про 2) і різко збільшувати цю віддачу в працюючих м'язах? Яка властивість олігомерних білків забезпечує цей ефект?
4. обчисліть, яку кількість Про 2 (в %) віддає оксигенований гемоглобін м'язі, що покоїться і працює?
5. Зробіть висновки про зв'язок структури білка з його функцією.
2. Кількість кисню, що звільняється гемоглобіном, в капілярах залежить від інтенсивності процесів катаболізму в тканинах (ефект Бору). Як зміни метаболізму в тканинах регулюють спорідненість НЬ до O2? Вплив СО 2 та Н+ на спорідненість НЬ до О 2
 1. Опишіть ефект Бора.
1. Опишіть ефект Бора.
2. у напрямі протікає процес, представлений на схеме:
а) у капілярах легень;
б) у капілярах тканин?
3. у чому фізіологічне значення ефекту Бора?
4. чому взаємодія Нв з Н+ на ділянках, віддалених від гема, змінює спорідненість білка до 2?
3. Спорідненість НЬв до О 2 залежить від концентрації його ліганду - 2,3-біфосфо-гліцерату, який є алостеричним регулятором спорідненості Нв до О 2 . Чому взаємодія ліганду в ділянці, віддаленій від активного центру, впливає на функцію білка? Як 2,3-БФГ регулює спорідненість НЬ до О 2? Для вирішення задачі дайте відповідь на наступні питання:
1. де і з чого синтезується 2.3-біфосфогліцерат (2,3-БФГ)? Напишіть його формулу, вкажіть заряд цієї молекули.
2. з якою формою гемоглобіну (окси чи дезокси) взаємодіє БФГ і чому? У якій ділянці молекули Нв відбувається взаємодія?
3. у якому напрямі протікає процес, поданий на схемі
а) у капілярах тканин;
б) у капілярах легень?
4. де має бути більш високою концентрація комплексу
НВ-2,3-БФГ:
а) у капілярах м'язів, які перебувають у стані спокою,
б) у капілярах працюючих м'язів (за умови однакової концентрації БФГ в еритроцитах)?
5. як зміниться спорідненість Нв до кисню при адаптації людини до умов високогір'я, якщо концентрація БФГ в еритроцитах у своїй підвищується? У чому фізіологічне значення цього явища?
4. Руйнування 2,3-БФГ при зберіганні консервованої крові порушує функції Нв. Як зміниться спорідненість Нв до O 2 у консервованій крові, якщо концентрація 2,3-БФГ в еритроцитах може зменшитися з 8 до 0,5 ммол/л. Чи можна переливати таку кров тяжкохворим пацієнтам, якщо концентрація 2,3-БФГ відновлюється не раніше ніж через три доби? Чи можна додаванням до крові 2,3-БФГ відновити функції еритроцитів?
5. Згадайте будову найпростіших молекул імуноглобулінів. Яку роль відіграють імуноглобуліни у роботі імунної системи? Чому Ig часто називають бівалентами? Як структура Ig пов'язана з їхньою функцією? (Опишіть на прикладі будь-якого класу імуноглобулінів.)
Фізико-хімічні властивості білків та методи їх поділу.
6. Як сумарний заряд білка впливає його розчинність?
а) визначте сумарний заряд пептиду при рН 7
Ала-Глу-Тре-Про-Асп-Ліз-Ціс
б) як зміниться заряд цього пептиду при рН >7, рН<7, рН <<7?
в) що таке ізоелектрична точка білка (ІЕТ) і в якому середовищі лежить
ІЕТ даного пептиду?
г) при якому значенні рН спостерігатиметься найменша розчинність даного пептиду.
7. Чому кисле молоко на відміну від свіжого при кип'ятінні «згортається» (тобто білок молока казеїн випадає в осад)? У свіжому молоці молекули казеїну мають негативний заряд.
8. Для розподілу індивідуальних білків використовується метод гельфільтрації. Суміш, що містить білки А, В, З молекулярними масами, рівними відповідно 160 000, 80 000 і 60 000, аналізували методом гель-фільтрації (рис. 1.35). Гранули набряклого гелю проникні для білків з молекулярною масою менше 70 000. Який принцип є основою даного методу поділу? Який із графіків правильно відображає результати фракціонування? Вкажіть порядок виходу білків А, В та С з колонки.
 Мал. 1.35. Використання методу гель-фільтрації для поділу білків
Мал. 1.35. Використання методу гель-фільтрації для поділу білків
9. На рис. 1.36 А представлена схема електрофорезу на папері білків сироватки крові здорової людини. Відносні кількості білкових фракцій, отриманих за допомогою цього методу, становлять: альбуміни 54-58%, α1-глобуліни 6-7%, α2-глобуліни 8-9%, β-глобуліни 13%, γ-глобуліни 11-12% .
 Мал. 1.36 Електрофорез на папері білків плазми крові здорової людини (А) та хворої (Б)
Мал. 1.36 Електрофорез на папері білків плазми крові здорової людини (А) та хворої (Б)
I - γ-глобуліни; II - β-глобуліни; III -α 2-глобулін; IV -α 2-глобулін; V - альбуміни
Багато хвороб супроводжуються кількісними змінами у складі сироваткових білків (диспротеїнемії). Характер цих змін враховується при постановці діагнозу та оцінці тяжкості та стадії захворювання.
За допомогою даних, наведених у табл. 1.5 зробіть припущення про захворювання, для якого характерний електрофоретичний профіль, представлений на рис. 1.36.
Таблиця 1.5. Зміна концентрації білків сироватки крові при патології
Біохімія- це наука про молекулярні основи життя, займається вивченням молекул, хімічних реакцій, процесів, які у живих клітинах організму. Поділяється на:
статичну (будову та властивості біомолекул)
динамічну (хімізм реакцій)
спеціальні розділи (екологічна, біохімія мікроорганізмів, клінічна)
Роль біохімії у вирішенні основних медичних проблем
збереження здоров'я людини
з'ясування причин різних захворювань та пошук шляхів їх ефективного лікування.
Таким чином, будь-яке нездужання, захворювання людини пов'язане з порушенням будови та властивостей метаболітів або біомолекул, також пов'язане зі змінами біохімічних реакцій, що протікають в організмі. Застосування будь-яких способів лікування, лікарських препаратів також ґрунтується на розумінні та точному знанні біохімізму їхньої дії.
Білки, їх будова та біологічна роль
Білки - це високомолекулярні поліпептиди, умовна межа між білками та поліпептидами зазвичай становить 8000-10000 одиниць молекулярної маси. Поліпептиди – це полімерні сполуки, що мають більше 10 залишків амінокислот у молекулі.
Пептиди - це сполуки, які з двох і більше залишків амінокислот (до 10) До складу білків входять лише L-амінокислоти.
Зустрічаються похідні амінокислот, наприклад, до складу колагену входить гідроксипролін та гідроксилізин. У деяких білках виявляється у -карбоксиглутамат. Порушення карбоксилювання глутамату у протромбіні може призвести до кровотечі. Часто у білках зустрічається фосфосерин.
Незамінні амінокислоти - це ті, що не синтезуються в організмі або
синтезуються у недостатній кількості або з малою швидкістю.
Для людини незамінними є 8 амінокислот: триптофан, фенілаланін,
метіонін, лізин, валін, треонін, ізолейцин, лейцин.
Біохімічні функції амінокислот:
будівельні блоки пептидів, поліпептидів та білків,
біосинтез інших амінокислот (з фенілаланіну синтезується тирозин, з метіоніну – цистеїн)
біосинтез деяких гормонів, наприклад, окситацину, вазопресину, інсуліну
вихідні продукти для утворення глутатіону, креатину
гліцин необхідний для синтезу порфірину
р - аланін, валін, цистеїн утворюють КоА, триптофан - нікотинамід, глутамінова кислота - фолієву кислоту
для біосинтезу нуклеотидів необхідний глутамін, гліцин, аспарагінова кислота, вони утворюють пуринові основи, глутамін та аспарагінова кислота – піримідинові.
11 амінокислот є глюкогенними, тобто здатні метаболізуватися в глюкозу та інші УВ
фенілаланін, тирозин, лейцин, лізин та триптофан беруть участь у біосинтезі деяких ліпідів
10. Освіта сечовини, вуглекислоти та енергії у вигляді АТФ.
Будова білків. Первинна структура.
Під первинною структурою розуміють послідовність амінокислот у ланцюзі, вони з'єднані між собою ковалентними пептидними зв'язками. Поліпептидна ланцюг починається з залишку, що має вільну аміногрупу (N - кінець) і завершується вільним СООН - кінцем.
До первинної структури також відносять взаємодію між залишками цистеїну з утворенням дисульфідних зв'язків.
Таким чином, первинна структура – це опис усіх ковалентних зв'язків у молекулі білка.
Пептидна зв'язок відрізняється полярністю, що з тим, що зв'язок між N і З частково носить характер подвійного зв'язку. Обертання утруднене і пептидна зв'язок має жорстку структуру. Послідовність амінокислот генетично строго детермінована, вона визначає нативну природу білка та його функції в організмі.
Вторинна структура
1951 р. - була розшифрована вторинна структура (тугозакручений основний ланцюг поліпептиду, яка становить внутрішню частину стрижня, бічні ланцюги спрямовані назовні, розташовуючись по спіралі) Всі -С=О-N-H-групи підстав ланцюга пов'язані водордними зв'язками.
Водневі зв'язки роблять а – спіраль більш стійкою.
Інший тип вторинної структури – це р – складчастий шар. Це паралельно лежать поліпептидні ланцюги, які пошиті водневими зв'язками. Можливе закручування таких р-утворень, що надає білку більшої міцності.
Третій тип вторинної структури уражає колагену. Кожен із трьох поліпептидних ланцюгів попередника колагену (тропоколаген) має форму спіралі. Три такі спіралізовані ланцюги закручуються щодо один одного, утворюючи тугу нитку.
Специфіка такого типу структури обумовлена наявністю водневих зв'язків суто між залишками гліцину, проліну та гідроксипроліну, а також внутрішньо- та міжмолекулярних ковалентних поперечних зв'язків.
Третиною структурою білка називається спосіб укладання поліпептидного ланцюга в тривимірному просторі. Така конформація виникає з допомогою утворення хімічних зв'язків між віддаленими друг від друга амінокислотними радикалами. Цей процес здійснюється за участю молекулярних механізмів клітини та відіграє величезну роль у наданні білкам функціональної активності.
Для третинної структури білків характерні такі типи хімічних взаємодій:
- іонні;
- водневі;
- гідрофобні;
- ван-дер-ваальсові;
- дисульфідні.
Всі ці зв'язки (крім дисульфідної ковалентної) дуже слабкі, проте за рахунок кількості стабілізують просторову форму молекули.
Фактично третій рівень укладання поліпептидних ланцюгів є комбінацією різних елементів вторинної структури (α-спіралей; β-складчастих шарів і петель), які орієнтуються в просторі за рахунок хімічних взаємодій між бічними амінокислотними радикалами. Для схематичного позначення третинної структури білка -спіралі позначаються циліндрами або спірально закрученими лініями, складчасті шари - стрілками, а петлі - простими лініями.

Характер третинної конформації визначається послідовністю амінокислот в ланцюзі, тому двом молекулам з однаковою первинною структурою за рівних умов відповідатиме той самий варіант просторового укладання. Така конформація забезпечує функціональну активність білка та називається нативною.

У процесі укладання білкової молекули відбувається зближення компонентів активного центру, які у первинної структурі може бути значно віддалені друг від друга.
Для одноланцюгових білків третинна структура є кінцевою функціональною формою. Складні многосубъединичные білки утворюють четвертинну структуру, що характеризує розташування кількох ланцюгів стосовно друг до друга.
Характеристика хімічних зв'язків у третинній структурі білка
Значною мірою згортання поліпептидного ланцюга обумовлено співвідношенням гідрофільних та гідрофобних радикалів. Перші прагнуть вступити у взаємодію Космосу з воднем (складовим елементом води) і тому перебувають у поверхні, а гидрофобные ділянки навпаки прямують у центр молекули. Така конформація енергетично найвигідніша. У результаті формується глобула із гідрофобною серцевиною.
Гідрофільні радикали, які все ж таки потрапляють у центр молекули, взаємодіють один з одним з утворенням іонних або водневих зв'язків. Іонні зв'язки можуть виникати між протилежно зарядженими амінокислотними радикалами, як яких виступають:
- катіонні групи аргініну, лізину або гістидину (мають позитивний заряд);
- карбоксильні групи радикалів глутамінової та аспарагінової кислоти (мають негативний заряд).

Водневі зв'язки утворюються при взаємодії незаряджених (OH, SH, CONH 2) та заряджених гідрофільних груп. Ковалентні зв'язки (найміцніші в третинній конформації) виникають між SH-групами цистеїнових залишків, формуючи так звані дисульфідні містки. Зазвичай ці групи віддалені одна від одної в лінійному ланцюзі і зближуються лише у процесі укладання. Дисульфідні зв'язки не характерні більшості внутрішньоклітинних білків.
Конформаційна лабільність
Так як зв'язки, що формують третинну структуру білка, дуже слабкі, броунівський рух атомів в амінокислотному ланцюзі може призвести до їхнього розриву та утворення в нових місцях. Це призводить до незначного зміни просторової форми окремих ділянок молекули, але не порушує нативну конформацію білка. Таке явище називають конформаційною лабільністю. Остання грає величезну роль фізіології клітинних процесів.
На конформацію білка впливають його взаємодії коїться з іншими молекулами чи зміни фізико-хімічних параметрів середовища.
Як утворюється третинна структура білка
Процес укладання білка у нативну форму називається фолдингом. В основі цього явища лежить прагнення молекули прийняти конформацію з мінімальним значенням вільної енергії.
Жоден білок не потребує посередників-інструкторів, які визначатимуть третинну структуру. Схема укладання спочатку «записана» у послідовності амінокислот.
Однак за звичайних умов, щоб велика білкова молекула прийняла нативну конформацію відповідно до первинної структури, їй знадобилося б більше трильйона років. Проте в живій клітині цей процес триває лише кілька десятків хвилин. Таке значне скорочення часу забезпечується участю у фолдингу спеціалізованих допоміжних білків - фолдаз та шаперонів.
Згортання маленьких білкових молекул (до 100 амінокислот у ланцюзі) відбувається досить швидко і без посередників, що показали експерименти in vitro.

Фактори фолдингу
Допоміжні білки, що беруть участь у фолдингу, діляться на дві групи:
- фолдази - мають каталітичну активність, потрібні в кількості, що значно поступається концентрації субстрату (як і інші ферменти);
- Шаперони - білки з різноманітними механізмами дії, потрібні в концентрації, порівнянній з кількістю субстрату, що згортається.
Обидва типи факторів беруть участь у фолдингу, але не входять до складу кінцевого продукту.
Групу фолдаз представляють 2 ферменти:
- Протеїндисульфідізомераза (ПДІ) - контролює правильне утворення дисульфідних зв'язків у білках з великою кількістю залишків цистеїну. Ця функція дуже важлива, оскільки ковалентні взаємодії дуже міцні, і у разі виникнення помилкових з'єднань білок не зміг би самостійно перебудуватися та прийняти нативну конформацію.
- Пептидил-пролил-цис-транс-ізомераза забезпечує зміну конфігурації радикалів, розташованих з обох боків від проліну, що змінює характер вигину поліпептидного ланцюга на цій ділянці.
Таким чином, фолдази виконують коригуючу роль в утворенні третинної конформації білкової молекули.
Шаперони
Шаперони інакше називаються білками теплового шоку чи стресу. Це з значним збільшенням їх секреції при негативних впливах на клітину (температура, радіація, важкі метали тощо. буд.).
Шаперони належать до трьох сімейств білків: hsp60, hsp70 та hsp90. Ці протеїни виконують безліч функцій, включаючи:
- захист білків від денатурації;
- виключення взаємодії щойно синтезованих білків друг з одним;
- попередження утворення неправильних слабких зв'язків між радикалами та їх лабіалізація (виправлення).

Таким чином, шаперони сприяють швидкому придбання енергетично правильної конформації, виключаючи випадковий перебір безлічі варіантів і захищаючи білкові молекули, що ще не дозріли, від непотрібної взаємодії один з одним. Крім цього, шаперони забезпечують:
- деякі види транспортування білків;
- контроль рефолдингу (відновлення третинної структури після втрати);
- підтримка стану незакінченого фолдингу (для деяких білків).
В останньому випадку молекула шаперона залишається пов'язаною з білком після завершення процесу укладання.
Денатурація
Порушення третинної структури білка під впливом будь-яких чинників називається денатурацією. Втрата нативної конформації відбувається при руйнуванні великої кількості слабких зв'язків, що стабілізують молекулу. Білок втрачає свою специфічну функцію, але зберігає первинну структуру (пептидні зв'язки під час денатурації не руйнуються).

При денатурації відбувається просторове збільшення білкової молекули, а гідрофобні ділянки знову виходять поверхню. Поліпептидна ланцюг набуває конформації безладного клубка, форма якого залежить від того, які зв'язки третинної структури білка були розірвані. У такому вигляді молекула більш чутлива до дії протеолітичних ферментів.
Чинники, що порушують третинну структуру
Існує ціла низка фізико-хімічних впливів, здатних викликати денатурацію. До них відносять:
- температуру понад 50 градусів;
- радіацію;
- зміна pH середовища;
- солі важких металів;
- деякі органічні сполуки;
- детергенти.
Після припинення денатуруючого впливу білок може відновити третинну структуру. Цей процес називається ренатурацією чи рефолдингом. В умовах in vitro таке можливе лише для невеликих білків. У живій клітині рефолдинг забезпечують шаперони.
